1. ýäť Űíá
ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČŰŐö ýŚÉŰäłýžÇýáÇý׹ý׹ý╣ś(ESS)ýŁś ýú╝ýÜö ŕÁČýä▒ÝĺłýŁ┤ŕ│á ýáäŕŞ░ý×ÉŰĆÖý░Ę Ű░Ć Ýť┤ŰîÇÝĆ░ Ű░░Ýä░ŰŽČ Űô▒ ŰőĄýľĹÝĽť ýÜęŰĆäŰíť ŰäÉŰŽČ ýéČýÜęŰÉśŕ│á ý׳ýť╝Űę░, ŕĚŞ ýłśýÜöŰŐö ýŽŁŕ░ÇÝĽśŰŐö ýÂöýäŞýŁ┤ŰőĄ. ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČŰŐö ýŚÉŰäłýžÇ ýŁ┤ýÜę ÝÜĘýťĘýä▒ Űô▒ ŰőĄýľĹÝĽť ý׹ýáÉýŁ┤ ý׳ýť╝Űéś, ýÁťŕĚ╝ ýŚÉŰäłýžÇýáÇý׹ý׹ý╣ś(ESS) Ű░Ć ýáäŕŞ░ ý×ÉŰĆÖý░Ę Űô▒ýŚÉýäť ÝÖöý×Č, ÝĆşŰ░ťýéČŕ│áŕ░Ç ýžÇýćŹýáüýť╝Űíť Ű░ťýâŁÝĽśŕ│á ý׳ýľ┤ ýŁ┤ýŐłŕ░Ç ŰÉśŕ│á ý׳ŰőĄ.
ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉ ŕŞ░ŕ│äýáü ýŁ┤ýâüýí░ŕ▒┤, ýáäŕŞ░ýáü ýŁ┤ýâüýí░ŕ▒┤ Ű░Ć ýŚ┤ýáü ýŁ┤ýâü ýí░ŕ▒┤ýŁ┤ Ű░ťýâŁÝĽśŰę┤ ýŚ┤ÝĆşýú╝ ÝśäýâüýŁ┤ Ű░ťýâŁÝĽťŰőĄ. ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőť Ű░ťýâŁýŚÉŰäłýžÇŕ░Ç ÝüČŕŞ░ ŰĽîŰČŞýŚÉ ýŁ┤Űą╝ ýáťýľ┤ÝĽśŕŞ░ ŰžĄýÜ░ ýľ┤ŰáĄýÜ┤ ýőĄýáĽýŁ┤ŰőĄ. ýŁ┤ŰčČÝĽť ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ýťäÝŚśýä▒ýŁä ŕ▓Żŕ░É ÝĽśŕ│áý×É ýĽłýáäŰîÇý▒ů ŰžłŰáĘýŁä ýťäÝĽť ŰőĄýľĹÝĽť ýŚ░ŕÁČŕ░Ç ýžäÝľëŰÉśŕ│á ý׳ŰőĄ.
ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ýŚ┤ÝĆşýú╝ ŰîÇýŁĹýŁä ýťäÝĽť ý▓ź Ű▓łýžŞ ŰőĘŕ│äŰŐö ýŚ┤ÝĆşýú╝ ýáäýŚÉ Ű░ťýâŁÝĽśŰŐö ŕ░ÇýŐĄŰą╝ ýí░ŕŞ░ýŚÉ ŕ░ÉýžÇÝĽśŰŐö ŕ▓âýŁ┤ŰőĄ. Ű│Ş ýŚ░ŕÁČýŚÉýäťŰŐö ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉýäť Ű░ťýâŁŰÉśŰŐö ŕ░ÇýŐĄŰą╝ ýŞíýáĽÝĽť ýőĄÝŚś ŕ▓░ŕ│╝Űą╝ ŰÂäýäŁÝĽśýśÇŰőĄ. ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉýäťŰŐö Ű▓ĄÝŐŞ Ű░Ć ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőť ýłśýćî, ýŁ╝ýé░ÝÖöÝâäýćî Ű░Ć ŰęöÝâäŕ░ÇýŐĄ Űô▒ýŁ┤ Ű░ťýâŁÝĽśýśÇŕ│á ýŚ┤ÝĆşýú╝ ýőťýáÉýŚÉ ýłťŕ░äýáüýť╝Űíť ŰőĄýľĹÝĽť ŕ░ÇýŐĄŰôĄýŁ┤ ŕ▓ÇýÂťŰÉśýŚłŰőĄ. ýőĄÝŚśýŁä ýťäÝĽ┤ ŰŽČÝŐČýŁ┤ýśĘýáäýžÇŰą╝ ýÖŞŕ┤ÇŰ│ä(ýŤÉÝćÁÝśĽ, ŕ░üÝśĽ, ÝîîýÜ░ý╣śÝśĽ), ýľĹŕĚ╣ý×ČŰ│ä(NCM, NCA, LFP)Űíť ŕÁČŰÂäÝĽśýśÇŕ│á ýŁ╝ýáĽÝĽť ÝüČŕŞ░ýŁś ý▒öŰ▓ä Űé┤ýŚÉýäť ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉ ýŚ┤ýáü ýŁ┤ýâü ýí░ŕ▒┤ýŁä ŕ░ÇÝĽśýŚČ ýőťŕ░äŰ│äŰíť Ű░ťýâŁÝĽśŰŐö ŕ░ÇýŐĄŰą╝ ýŞíýáĽÝĽśýśÇŰőĄ. ŕ░ÇýŐĄ ýŞíýáĽýŁä ýťäÝĽ┤ FT-IR ŰÂäýäŁý׹ý╣śŰą╝ ýéČýÜęÝĽśýśÇýť╝Űę░, Ű│äŰĆäýŁś ýłśýćî ýä╝ýäťŰą╝ ý▒öŰ▓ä Űé┤ýŚÉ ýäĄý╣śÝĽśýŚČ ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ŕ░ÇýŐĄ ýóůŰąś Ű░Ć ýľĹýŁä ýőĄýőťŕ░äýť╝Űíť ŰÂäýäŁÝĽśýśÇŰőĄ.
ýőĄÝŚś ŕ▓░ŕ│╝ ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉýäť ŰőĄýľĹÝĽť ŕ░ÇýŐĄŕ░Ç Ű░ťýâŁÝĽśýśÇŕ│á, ýŚ┤ÝĆşýú╝ ýŁ┤ÝŤäýŚÉŰŐö ŰőĄŰčëýŁś ýŁ┤ýé░ÝÖöÝâäýćî Ű░Ć ýŁ╝ýé░ÝÖöÝâäýćî Űô▒ýŁ┤ Ű░░ýÂťŰÉśýŚłŰőĄ. ýőĄÝŚś ŕ▓░ŕ│╝Űą╝ ÝćÁÝĽśýŚČ ýŚ┤ÝĆşýú╝ ýőť ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉýäť Ű░ťýâŁŰÉśŰŐö ŕ░ÇýŐĄ Ű░ťý⣠ÝŐ╣ýä▒ýŚÉ ŰîÇÝĽśýŚČ ŰÂäýäŁÝĽśŕ│á, ýŁ┤ýŚÉ ŰîÇÝĽť ýťäÝŚśŕ▓Żŕ░É Ű░ęýĽłýŁä ýáťýőťÝĽśýŚČ ÝÖöý×Č Ű░Ć ÝĆşŰ░ť ýéČŕ│á ŰîÇý▒ůýŚÉ ŰîÇÝĽť ŕŞ░Ű░śýŁä ŰžłŰáĘÝĽśŕ│áý×É ÝĽťŰőĄ.
2. ŰŽČÝŐČýŁ┤ýśĘýáäýžÇ ÝŐ╣ýä▒
2.1 ŕÁČýä▒ýÜöýćî
ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČŰŐö ýÂęýáä ýőť ŰŽČÝŐČýŁ┤ýśĘýŁä ýáťŕ│ÁÝĽśŰŐö ýľĹŕĚ╣(cathod), ŰŽČÝŐČýŁ┤ýśĘýŁä ýáÇý׹ݼśŰŐö ýŁîŕĚ╣(anode), ýľĹŕĚ╣ŕ│╝ ýŁîŕĚ╣ýŚÉýäť Ű░ťýâŁÝĽť ýáäý×Éŕ░Ç ýÖŞŰÂÇ ÝÜîŰíťŰą╝ ÝćÁÝĽá ýłś ý׳ŰĆäŰíŁ Űé┤ŰÂÇ ŰőĘŰŁŻýŁä Ű░ęýžÇÝĽśŰŐö ŰÂäŰŽČŰžë(seperator), ŰŽČÝŐČýŁ┤ýśĘýŁ┤ ýŁ┤ŰĆÖÝĽá ýłś ý׳ŰŐö ŕ│Áŕ░äŕ│╝ ÝÖśŕ▓ŻýŁä ýáťŕ│ÁÝĽśŰŐö ýáäÝĽ┤ýĽí(electrolyte) Űô▒ýť╝Űíť ŕÁČýä▒ŰÉťŰőĄ(
1).
ŰÂäŰŽČŰžëýŁÇ ýľĹŕĚ╣ŕ│╝ ýŁîŕĚ╣ýŁ┤ ýäťŰíť ýä×ýŁ┤ýžÇ ýĽŐŰĆäŰíŁ ŰČ╝ŰŽČýáüýť╝Űíť ŰžëýĽäýú╝ŰŐö ýŚşÝĽáŰ┐ÉŰžî ýĽäŰőłŰŁ╝, ýáäý×Éŕ░Ç ýáäÝĽ┤ýĽíýŁä ÝćÁÝĽ┤ ýžüýáĹ ÝŁÉŰą┤ýžÇ ýĽŐŰĆäŰíŁ ÝĽśŕ│á, Űé┤ŰÂÇýŁś Ű»ŞýäŞÝĽť ŕÁČŰęŹýŁä ÝćÁÝĽ┤ ýŤÉÝĽśŰŐö ýŁ┤ýśĘŰžî ýŁ┤ŰĆÖÝĽá ýłś ý׳ŕ▓î ŰžîŰôáŰőĄ. ŰÂäŰŽČŰžëýŁ┤ ýćÉýâüŰÉśŰę┤ Ű░░Ýä░ŰŽČýŁś Űé┤ŰÂÇ ŰőĘŰŁŻýť╝Űíť ýŁŞÝĽśýŚČ ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉá ýłś ý׳ŰőĄ(
2). Űö░ŰŁ╝ýäť, ŰÂäŰŽČŰžëýŁÇ Ű░░Ýä░ŰŽČýŁś ýĽłýáäýä▒ýŁä ŕ▓░ýἠýžôŰŐö ŕÁČýä▒ ýÜöýćîŰŁ╝ŕ│á ÝĽá ýłś ý׳ŰőĄ.
ýáäÝĽ┤ýĽíýŁÇ ŰŽČÝŐČýŁ┤ýśĘýŁ┤ ýžÇŰéśŕ░ł ýłś ý׳ŰŐö ýŁ┤ŰĆÖ ÝćÁŰíť ýŚşÝĽáýŁä ÝĽśŰŐö ýŚ╝, ýŚ╝ýŁä ýÜęÝĽ┤ ýőťÝéĄŕŞ░ ýťäÝĽ┤ ýéČýÜęŰÉśŰŐö ýĽíý▓┤ýŁŞ ýÜęŰžĄ, ÝŐ╣ýἠ۬ęýáüýŁä ýťäÝĽ┤ ýćîŰčëýť╝Űíť ý▓Ęŕ░ÇŰÉśŰŐö ŰČ╝ýžłýŁŞ ý▓Ęŕ░ÇýáťŰíť ŕÁČýä▒ŰÉśýľ┤ ý׳ŰőĄ(
3).
2.2 ýŚ┤ÝĆşýú╝
ýŚ┤ÝĆşýú╝ Űęöý╣┤ŰőłýŽśýŁÇ ýŚ░ýçä Ű░śýŁĹýť╝Űíť ÝĽ┤ýäŁýŁ┤ ŕ░ÇŰչݼśŰę░, ýśĘŰĆäŕ░Ç Ű╣äýáĽýâüýáüýť╝Űíť ýâüýŐ╣ÝĽśŰę┤ ÝÖöÝĽÖ Ű░śýŁĹýŁ┤ ýłťý░Ęýáüýť╝Űíť ýŁ╝ýľ┤ŰéśŰŐö ýŚ░ýçä Ű░śýŁĹýŁä ÝśĽýä▒ÝĽśŕ▓î ŰÉśŰŐöŰŹ░, ýŁ┤Űą╝ ýŁ╝ý╗źŰŐö heat- temperature-reaction (HTR) ŰúĘÝöäŰŐö ýŚ░ýçä Ű░śýŁĹýŁś ŕĚ╝Ű│Ş ýŤÉýŁŞýŁ┤ŰőĄ(
4-
6). ŕÁČý▓┤ýáüýť╝Űíť, Ű╣äýáĽýâüýáüýŁŞ Ű░ťýŚ┤ýŁÇ ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ýśĘŰĆäŰą╝ ýâüýŐ╣ýőťÝéĄŕ│á SEI ŰÂäÝĽ┤ýÖÇ ŕ░ÖýŁÇ ŰÂÇŰ░śýŁĹýŁä ýőťý×ĹÝĽťŰőĄ. ŰÂÇŰ░śýŁĹýŁÇ ŰŹö ŰžÄýŁÇ ýŚ┤ýŁä Ű░ęýݼśýŚČ HTR ŰúĘÝöäŰą╝ ÝśĽýä▒ÝĽťŰőĄ. HTR ŰúĘÝöäŰŐö ýůÇýŁ┤ ýŚ┤ÝĆşýú╝Űą╝ ŕ▓¬ýŁä ŰĽîŕ╣îýžÇ ŕĚ╣ŰĆäŰíť ŰćĺýŁÇ ýśĘŰĆäýŚÉýäť ýłťÝÖśŰÉťŰőĄ(
4).
ÝĽ┤Űő╣ ŕ│╝ýáĽýŚÉýäť SEI ŰÂäÝĽ┤, ýľĹŕĚ╣ŕ│╝ ýáäÝĽ┤ýžłýŁś Ű░śýŁĹ, PE (ŰÂäŰŽČŰžë ý×ČŰúî)ýŁś ýÜęýťÁ, NCM ýŁîŕĚ╣ýŁś ŰÂäÝĽ┤, ýáäÝĽ┤ýĽíýŁś ŰÂäÝĽ┤ Űô▒ýŁ┤ ýłťý░Ęýáüýť╝Űíť ýžäÝľëŰÉťŰőĄ(
5). ŰÂäŰŽČŰžëýŁś ýäŞŰŁ╝Ű»╣ ýŻöÝîůýŁ┤ Ýîîŕ┤┤ŰÉśŰę┤ ŰîÇŕĚťŰ¬Ę Űé┤ŰÂÇ ŰőĘŰŁŻýť╝Űíť ýŁŞÝĽ┤ Ű░░Ýä░ŰŽČýŁś ýáäŕŞ░ ýŚÉŰäłýžÇŕ░Ç ýłťŕ░äýáüýť╝Űíť Ű░ęýÂťŰÉśýľ┤ ýáäÝĽ┤ýĽíýŁ┤ ýŚ░ýćî ŰÉá ýłś ý׳ŰŐö ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁÝĽťŰőĄ(
6). Ű░░Ýä░ŰŽČýŁś ýŁîŕĚ╣ Ű░Ć ýľĹŕĚ╣ ý×ČŰúîŰŐö ýŚ┤ÝĆşýú╝ ýőť ýáäÝĽ┤ýĽíŕ│╝ Ű░śýŁĹÝĽśŰę░, ýáäÝĽ┤ýĽíýŁÇ ýŚ┤ÝĆşýú╝ ŰĆÖýĽł ŰÂäÝĽ┤ŰÉá ýłś ý׳ŰőĄ. ýáäÝĽ┤ýĽí ýĄĹýŁś LiPF
6 ýŚ╝ýŁÇ ŰÂäÝĽ┤ Ű░śýŁĹýť╝Űíť HF Űô▒ýŁä ÝĆČÝĽĘÝĽť ŰČ╝ýžłýŁä ýâŁýä▒ÝĽśŕ▓î ŰÉťŰőĄ(
7).
ýáäÝĽ┤ýžłýŁś ýľĹýŁÇ ýŚ┤ÝĆşýú╝ ŰĆÖýĽł Ű░░Ýä░ŰŽČýŁś ýŚ┤ ýâŁýä▒ýŚÉ ýśüÝľąýŁä ýĄä ýłś ý׳ýť╝Űę░, ýŁ┤ŰŐö ŕ░ÇýŐĄ Ű░ťýâŁŕ│╝ŰĆä ýžüŕ▓░ŰÉť ŰČŞýáťŰíť ýâŁŕ░üŰÉťŰőĄ. Dahn Űô▒(
8)ýŁÇ LMO/ýáäÝĽ┤ýĽíýŁś ŕ▓ŻýÜ░, ýáäÝĽ┤ýĽíýŁ┤ ýÂöŕ░ÇŰÉáýłśŰíŁ Ű░ťýŚ┤ ŰśÉÝĽť ýŽŁŕ░ÇÝĽťŰőĄŰŐö ŕ▓âýŁä Ű░ťŕ▓ČÝľłŰőĄ.
ŰőĘ, Ýśäý×ČŰŐö ýŁ┤ŰčČÝĽť ý×ČŰúîýŁś ŰÂäýäŁýť╝ŰíťŰžî ýŚ┤ÝĆşýú╝ ŕ▒░ŰĆÖýŁä ýśłýŞíÝĽá ýłś ýŚćýľ┤ ÝĽ┤Űő╣ ŕŞ░ýłáýŁś ŕ░ťŰ░ťýŁ┤ ýőťŕŞëÝĽť ýâüÝâťýŁ┤ŰőĄ. ŕ┤ÇŰáĘ ýŚ░ŕÁČ Ű░Ć ŕŞ░ýłá ŕ░ťŰ░ťýŁÇ Ű░░Ýä░ŰŽČ ýäĄŕ│äýŁś ýĽłýáäýä▒ ÝľąýâüýŚÉ ŰžĄýÜ░ ýĄĹýÜöÝĽť ýÜöýćîŰíť ý×ĹýÜę ŰÉá ŕ▓âýŁ┤ŰőĄ.
2.3 ýŁ┤ýâü ýí░ŕ▒┤
ýŚ┤ÝĆşýú╝Űą╝ Ű░ťýâŁýőťÝéĄŕŞ░ ýťäÝĽśýŚČ ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉ ýŁŞýťäýáüýť╝Űíť ŕ░ÇÝĽá ýłś ý׳ŰŐö ŰîÇÝĹťýáüýŁŞ ýŁ┤ýâü ýí░ŕ▒┤ýť╝ŰíťŰŐö ŕ│╝ýÂęýáä, ŕ░ÇýŚ┤ Űô▒ýŁ┤ ý׳ŰőĄ.
ŕ│╝ýÂęýáäýŁÇ ÝćÁýâü Ű░░Ýä░ŰŽČýŚÉ ýŁ╝ýἠýáäŰąśŰą╝ ýžÇýćŹýáüýť╝Űíť ýŁŞŕ░ÇÝĽśŰŐö Ű░ęýőŁýť╝Űíť ýłśÝľëŰÉťŰőĄ. State of charge (SOC) 130% ý┤łŕ│╝ ýőť ýÜęŰčë ýćÉýőĄýŁ┤ ÝüČŕ│á ýŁ┤ŰŐö Ű░░Ýä░ŰŽČ ýłśŰ¬ůýŚÉ ýžüŕ▓░ŰÉá ýłś ý׳ýť╝Űę░, SOC 140%ŕ░Ç ý┤łŕ│╝ŰÉá ŕ▓ŻýÜ░ýŚÉŰŐö ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉá ýłś ý׳ŰőĄ(
9). ýľĹŕĚ╣ýŚÉ NCM+LMO, ýŁîŕĚ╣ýŚÉ graphiteŰą╝ ýéČýÜęÝĽśŰŐö ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ŕ│╝ýÂęýáä ýőť Ýö╝ÝüČ ýáäýĽĽýŁÇ ýĽŻ 5.4 V ŕ░ÇŰčëýť╝Űíť ÝÖĽýŁŞŰÉśŰę░, ÝĽ┤Űő╣ ýáäýĽĽýŁä ý┤łŕ│╝ÝĽť SOCýŚÉýäť ýŚ┤ÝĆşýú╝ŕ░Ç ýťáŰ░ťŰÉśýŚłŰőĄ(
10).
ŕ░ÇýŚ┤ Ű░ęýőŁýť╝ŰíťŰŐö Ű░░Ýä░ŰŽČ 1Űę┤ ýáäý▓┤Űą╝ ŕ░ÇýŚ┤ÝĽśŰŐö ýŚ┤ÝîÉŕ░ÇýŚ┤ Ű░ęýőŁ, ÝĽäŰŽäÝ׳Ýä░ Űô▒ýŁä ýéČýÜęÝĽśýŚČ ýŁ╝ŰÂÇŰÂäŰžî ŕ░ÇýŚ┤ÝĽśŰŐö ŕÁşŰÂÇŕ░ÇýŚ┤ Ű░ęýőŁ Űô▒ýŁ┤ ý׳ýť╝Űę░, ýŚ┤ýŤÉýŁÇ ýÖŞŰÂÇ ŰśÉŰŐö Űé┤ŰÂÇýŚÉýäť ŕ░ÇÝĽá ýłś ý׳ýť╝Űéś ýÖŞŰÂÇýŚÉýäť ýŚ┤ÝîÉ Űô▒ýŁä ýŁ┤ýÜęÝĽśýŚČ ŕ░ÇýŚ┤ÝĽśŰŐö ŕ▓âýŁ┤ ýŁ╝Ű░śýáüýŁ┤ŰőĄ.
ŕ│╝ýÂęýáäýŁś ŕ▓ŻýÜ░ýŚÉŰŐö Ű░░Ýä░ŰŽČ Űé┤ŰÂÇýŚÉ ŕ│╝ýÂęýáä Ű│┤ÝśŞÝÜîŰíťŕ░Ç ýäĄý╣śŰÉśýľ┤ ý׳ŕ▒░Űéś ýÜęŰčë(Ah)ýŁ┤ Ýü░ Ű░░Ýä░ŰŽČýŁś ŕ▓ŻýÜ░ ýáĽŕ▓ę ýÂęýáä ýáäŰąśŰą╝ 50% ýŁ┤ýâüýť╝Űíť ŰćĺýŚČýĽ╝ ÝĽśŰŐö ŰÂÇŰÂä Űô▒ýŁ┤ ýí┤ý×ČÝĽśýŚČ, ýŚ┤ÝîÉ ŕ░ÇýŚ┤ýŁä ýŁ┤ýÜęÝĽśýŚČ ýŚ┤ÝĆşýú╝Űą╝ ýťáŰĆäÝĽśýśÇýť╝Űę░ ýŁ┤ŰĽî Ű░ťý⣠ŰÉśŰŐö ŕ░ÇýŐĄŰą╝ ýŞíýáĽÔőůŰÂäýäŁÝĽśýśÇŰőĄ.
3. ýőĄÝŚś ý׹ý╣ś Ű░Ć Ű░ęŰ▓Ľ
3.1 ýőĄÝŚśý׹ý╣ś
Ű│Ş ýŚ░ŕÁČýŚÉýäťŰŐö ýŚ┤ÝĆşýú╝Űą╝ ýťáŰĆäÝĽśýŚČ ŕ░ÇýŐĄŰą╝ Ű░ťýâŁýőťÝéĄŰŐö ŕ▓âýŁ┤ ۬ęýáüýť╝Űíť, ŕ│╝ýÂęýáäŰ│┤ŰőĄŰŐö Ű╣äŕÁÉýáü Ű╣áŰą┤ŕ│á ÝÖĽýőĄÝĽśŕ▓î ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉá ýłś ý׳ŰĆäŰíŁ ýŚ┤ÝîÉýť╝Űíť ŕ░ÇýŚ┤ÝĽśŰŐö Ű░ęýőŁýŁä ÝâŁÝĽśýśÇŰőĄ.
Figure 1ŕ│╝ ŕ░ÖýŁ┤ ýőĄÝŚśýÜę ý▒öŰ▓äŰą╝ ýáťý×ĹÝĽśýŚČ ýÖŞŰÂÇ ýí░ŕ▒┤ýŚÉ ýśüÝľąýŁä Ű░ŤýžÇ ýĽŐŰĆäŰíŁ ý▒öŰ▓ä Űé┤ŰÂÇýŚÉýäť ýőĄÝŚśýŁä ýőĄýőťÝĽśýśÇŰőĄ. ý▒öŰ▓äýŁś ŕ░ÇŰíť, ýäŞŰíť, ŰćĺýŁ┤Űą╝ ŕ░ü 1.5 mŰíť ýáťý×ĹÝĽśýśÇýť╝Űę░, ýťíýĽłýť╝ŰíťŰĆä ýŚ┤ÝĆşýú╝ ÝÖĽýŁŞýŁ┤ ŕ░ÇŰչݼśŰĆäŰíŁ ŕ┤Çý░░ýÜę ŕ░ĽÝÖöýťáŰŽČŰą╝ ý▒öŰ▓ä ýáäŰę┤ýŚÉ ýäĄý╣śÝĽśýśÇŰőĄ.
Figure 1
Experimental chamber with data measuring device.

ŕ░ÇýŐĄ ýŞíýáĽýŁä ýťäÝĽśýŚČ FT-IR ŰÂäýäŁý׹ý╣ś(Model: I1801-E, Detector: MCT) Ű░Ć ýłśýćî ýä╝ýäťŰą╝ ý▒öŰ▓ä Űé┤ýŚÉ ýäĄý╣śÝĽśýŚČ ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉýäť Ű░ťý⣠ŰÉśŰŐö ŕ░ÇýŐĄýŁś ýóůŰąśŰ│ä ŰćŹŰĆäŰą╝ ýőĄýőťŕ░äýť╝Űíť ýŞíýἠŰ░Ć ŰÂäýäŁÝĽśýśÇŰőĄ. FT-IR ŰÂäýäŁý׹ý╣śŰŐö ppm ŰőĘýťäŰíť ŰćŹŰĆäŕ░Ç ýŞíýáĽŰÉśŰę░, ýłśýćî ýä╝ýäťŰŐö vol% ŰőĘýťäŰíť ýŞíýáĽŰÉťŰőĄ. ýłśýćîýä╝ýäťýŁś ýŞíýἠŰ▓öýťäŰŐö 0~4 vol%ýŁ┤ŰőĄ.
ýőĄÝŚśýŚÉ ýéČýÜęŰÉť ýśĘŰĆäýä╝ýäťŰŐö K-Type (0.254 mm) ýŚ┤ýáäŰîÇŰíť ýŚ┤ÝĆşýú╝ ýőťýáÉ ÝÖĽýŁŞ Űô▒ ŰÂäýäŁýŁ┤ ŕ░ÇŰչݼśŰĆäŰíŁ ýőĄÝŚś ÝŐ╣ýä▒ýŚÉ Űž×ŕ▓î ýäĄý╣śÝĽśýśÇŰőĄ. ŕ░üÝśĽ Ű░░Ýä░ŰŽČŰŐö Ű▓ĄÝŐŞŕ░Ç Ű░ťý⣠ŰÉśŰŐö Ű░░ýÂťŰ│Ç, Ű░░Ýä░ŰŽČ ýáäŰę┤ Ű░Ć ýŞíŰę┤ýŚÉ ýŚ┤ýáäŰîÇ 3ŕ░ťŰą╝ ŰÂÇý░ęÝĽśýśÇŕ│á, ÝîîýÜ░ý╣śÝśĽýŁÇ ýáäŰę┤ŕ│╝ ÝŤäŰę┤ýŚÉ 2ŕ░ťŰą╝ ŰÂÇý░ęÝĽśýśÇŰőĄ. ýŤÉÝćÁÝśĽýŁÇ 2ýŚ┤Űíť Ű░░ý╣śÝĽśýŚČ, 1ýŚ┤ŕ│╝ 2ýŚ┤ýŁś ŕ░ü ŕ░ÇýÜ┤ŰŹ░ ýůÇýŁś ýĄĹýĽÖŰÂÇýŚÉ ýŚ┤ýáäŰîÇŰą╝ ŰÂÇý░ęÝĽśýśÇŰőĄ. ŰŹ░ýŁ┤Ýä░ ýĚĘŰôŁýŁä ýťäÝĽ┤ ŰŹ░ýŁ┤Ýä░ ýłśýžĹŕŞ░(GL840-WV)Űą╝ ýéČýÜęÝĽśýśÇýť╝Űę░, ýŚ┤ýáäŰîÇŰą╝ ÝćÁÝĽśýŚČ ýŞíýáĽŰÉť ýśĘŰĆäŰą╝ ýőĄýőťŕ░äýť╝Űíť ŕŞ░ŰíŁ┬ĚýáÇý׹ݼśýśÇŰőĄ.
3.2 ýőĄÝŚśŰ░ęŰ▓Ľ
ýőĄÝŚśýŁä ýťäÝĽ┤ ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČŰą╝ ýÖŞŕ┤ÇŰ│ä(ýŤÉÝćÁÝśĽ, ŕ░üÝśĽ, ÝîîýÜ░ý╣śÝśĽ), ýľĹŕĚ╣ý×ČŰ│ä(NCM, NCA, LFP)Űíť ŕÁČŰÂäÝĽśýŚČ ýőĄÝŚśýŁä ýžäÝľëÝĽśýśÇŰőĄ. ŰśÉÝĽť, ŕ░ü Ű░░Ýä░ŰŽČýŁś ýÜęŰčëýŁÇ ۬ĘŰĹÉ ŰőĄŰąŞ ýáťÝĺłýť╝Űíť ýőĄÝŚśýŁä ýłśÝľëÝĽśýśÇŰőĄ.
ýőťÝŚśý▓┤ýŁŞ ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČŰŐö ýůÇ ŰőĘýťäŰíť ýőĄÝŚśýŁä ýłśÝľëÝĽśýśÇŰőĄ. ŕ░üÝśĽ Ű░Ć ÝîîýÜ░ý╣śÝśĽ Ű░░Ýä░ŰŽČŰŐö ýőĄÝŚś 1ÝÜîŰő╣ 1ŕ░ť ýůÇŰíť, ýŤÉÝćÁÝśĽ Ű░░Ýä░ŰŽČŰŐö ýőĄÝŚś 1ÝÜîŰő╣ 10ŕ░ťŰíť ýžäÝľëÝĽśýśÇŰőĄ.
NCM ŕ│äýŚ┤ Ű░░Ýä░ŰŽČŰŐö ŕ░üÝśĽýť╝Űíť 1ÝÜî, ÝîîýÜ░ý╣śÝśĽýť╝Űíť 3ÝÜî, ýŤÉÝćÁÝśĽýť╝Űíť 1ÝÜî ýőĄÝŚśýŁä ýőĄýőťÝĽśýśÇýť╝Űę░, NCA ŕ│äýŚ┤ Ű░░Ýä░ŰŽČŰŐö ýŤÉÝćÁÝśĽýť╝Űíť 2ÝÜî ýőĄÝŚśýŁä ýőĄýőťÝĽśýśÇŕ│á, LFP ŕ│äýŚ┤ Ű░░Ýä░ŰŽČŰŐö ÝîîýÜ░ý╣śÝśĽýť╝Űíť 1ÝÜî ýőĄÝŚśýŁä ýőĄýőťÝĽśýŚČ, ý┤Ł 10ÝÜî ýőĄÝŚśýŁ┤ ýőĄýőťŰÉśýŚłŰőĄ.
ý▒öŰ▓ä Űé┤ŰÂÇýŚÉýäť ýŚ┤ÝîÉ Ý׳Ýä░Űíť SOC 100% ýâüÝâťýŁś ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉ ýŚ┤ýáü ýŁ┤ýâü ýí░ŕ▒┤ýŁä ŕ░ÇÝĽśýŚČ ýŚ┤ÝĆşýú╝ ýőť Ű░ťý⣠ŰÉśŰŐö ŕ░ÇýŐĄŰą╝ ýőĄýőťŕ░äýť╝Űíť ýŞíýáĽÝĽśýśÇŰőĄ.
UL 9540A ŕŞ░ýĄÇýŚÉ Űö░ŰŁ╝ ŕ░ÇýŐĄ ýŞíýáĽýŁä ýťäÝĽ┤ ý▒öŰ▓ä Űé┤ ýžłýćî ýú╝ý×ůýť╝Űíť ý┤łŕŞ░ ýé░ýćîŰćŹŰĆäŰą╝ 1% ýŁ┤ÝĽśŰíť Űé«ýÂöýľ┤ ýőĄÝŚśýŁä ýłśÝľëÝĽśýśÇŰőĄ.
Table 1ýŁÇ Ű│Ş ýŚ░ŕÁČýŚÉ ýéČýÜęŰÉť ýőťŰúîýŁŞ ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ŕŞ░Ű│ŞýáüýŁŞ ýéČýľĹýŁä ýáĽŰŽČÝĽť ŕ▓âýŁ┤ŰőĄ.
Table 1
Specification of Lithum-ion Batteries
|
No. |
Cathod |
Type |
Capacity (Ah) |
No. of Cells |
|
1 |
NCM*
|
Prismatic |
120 |
1 |
|
2 |
Pouch |
63 |
1 |
|
3 |
Pouch |
70 |
1 |
|
4 |
Pouch |
30 |
1 |
|
5 |
Cylindrical |
3.3 |
10 |
|
6 |
NCA**
|
Cylindrical |
5 |
10 |
|
7 |
Cylindrical |
2.5 |
10 |
|
8 |
LFP***
|
Pouch |
20 |
1 |
Figure 2ŕ│╝ ŕ░ÖýŁ┤ ýŚ┤ÝîÉ ýťä ýůÇýŁä ýśČŰáĄŰćôýŁÇ ýâüÝâťýŚÉýäť ýŚ┤ÝîÉ Ý׳Ýä░Űą╝ ýŁ┤ýÜęÝĽśýŚČ ýśĘŰĆäŰą╝ ŰÂäŰő╣ 4~7 ┬░C Ű▓öýťäŰíť ýâüýŐ╣ýőťý╝░ýť╝Űę░, ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőťŕ░äýŁÇ ýůÇ ÝśĽÝâťýŚÉ Űö░ŰŁ╝ ŰőĄŰą┤ŕ▓î ŰéśÝâÇŰéČýžÇŰžî ۬ĘŰĹÉ 50 min ýŁ┤Űé┤Űíť Ű░ťýâŁŰÉśýŚłŰőĄ.
Figure 2
Pouch type battery cell on heating plate.

4. ýőĄÝŚś ŕ▓░ŕ│╝ Ű░Ć ŰÂäýäŁ
Ű▓ĄÝŐŞ Ű░ťý⣠ýőťŕ░ä Ű░Ć ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőťŕ░äýŁÇ ýľĹŕĚ╣ý×Č Ű░Ć ýůÇ ÝśĽÝâťýŚÉ Űö░ŰŁ╝ ŰőĄŰą┤ŕ▓î ŰéśÝâÇŰéČýť╝Űę░, ýŚČŕŞ░ýäť Ű▓ĄÝŐŞ Ű░ťý⣠ýőťŕ░ä(vent operating time)ýŁÇ Ű░░Ýä░ŰŽČ Űé┤ŰÂÇýŁś ŕ░ÇýŐĄŕ░Ç ýÖŞŰÂÇŰíť ŰÂäýݼśýśÇýŁä ŰĽîýŁś ýőťŕ░äýŁä ýŞíýáĽÝĽť ŕ▓âýŁ┤ŰőĄ. NCM ŕ│äýŚ┤ýŁś ŕ▓ŻýÜ░, ÝîîýÜ░ý╣śÝśĽýŚÉýäť Ű▓ĄÝŐŞ Ű░Ć ýŚ┤ÝĆşýú╝ŕ░Ç ŕ░Çý׹ ŰĘ╝ýáÇ Ű░ťýâŁÝĽśýśÇýť╝Űę░, ýŤÉÝćÁÝśĽýŚÉýäť Ű▓ĄÝŐŞ Ű░Ć ýŚ┤ÝĆşýú╝ŕ░Ç ŕ░Çý׹ ŰŐŽŕ▓î Ű░ťýâŁŰÉśýŚłŰőĄ.
ýľĹŕĚ╣ý×Č ýóůŰąśýÖÇ ŕ┤Çŕ│äýŚćýŁ┤ ýáäŰ░śýáüýť╝Űíť ÝîîýÜ░ý╣śÝśĽýŚÉýäť ýŚ┤ÝĆşýú╝ŕ░Ç ŕ░Çý׹ ýŁ╝ý░Ź Ű░ťýâŁÝĽśŕ│á, ŕ░üÝśĽ(prismatic)ŕ│╝ ýŤÉÝćÁÝśĽ(cylindrical)ýŚÉýäť ýŚ┤ÝĆşýú╝ŕ░Ç ŰŐŽŕ▓î Ű░ťýâŁŰÉśŰŐö ŕ▓âýŁä ÝÖĽýŁŞÝĽá ýłś ý׳ýŚłŰőĄ. ŰőĘ, ÝîîýÜ░ý╣śÝśĽýŁÇ ÝĽťý¬Ż Űę┤ ýáäý▓┤ŕ░Ç ýŚ┤ÝîÉŕ│╝ ýáĹý┤ëÝĽśýžÇŰžî, ŕ░üÝśĽ Ű░Ć ýŤÉÝćÁÝśĽýŁÇ ýĽäŰןŰę┤Űžî ýŚ┤ÝîÉýŚÉ ýžüýáĹ Űő┐ŰŐö ÝśĽÝâťŰíť ýłśýŚ┤ Űę┤ýáüýŁ┤ ÝîîýÜ░ý╣śÝśĽŰ│┤ŰőĄ ýáüýŁÇ ýśüÝľąýŁ┤ ý׳ýŁä ŕ▓âýť╝Űíť Ű│┤ýŁŞŰőĄ. ŰśÉÝĽť, ýőĄÝŚśýŁä ÝćÁÝĽśýŚČ ýÜęŰčë (Ah)ŕ│╝ Ű▓ĄÝŐŞ Ű░Ć ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőťŕ░äŕ│╝ŰŐö ýâüŕ┤Çŕ┤Çŕ│äŕ░Ç ýŚćýŁîýŁä ÝÖĽýŁŞÝĽá ýłś ý׳ýŚłŰőĄ.
Table 2ŰŐö ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ŕ░ÇýŐĄ Ű░ťýâŁýŁä ýťäÝĽť ýŚ┤ÝĆşýú╝ ýőĄÝŚś ŕ▓░ŕ│╝ýŁ┤ŰőĄ. ýŁ┤ ÝĹťýŚÉýäťŰŐö ýľĹŕĚ╣ý×ČŰ│ä, ýÖŞŕ┤ÇŰ│äŰíť Ű▓ĄÝŐŞ Ű░ťý⣠ýőťŕ░äŕ│╝ ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőťŕ░äýŁä ýáĽŰŽČÝĽśýśÇŰőĄ.
Table 2
Results of the Experiment
|
No. |
Cathod |
Type |
Vent operating time |
Time to TR*
|
|
1 |
NCM |
Prismatic |
40:13 |
40:20 |
|
2 |
Pouch |
19:21 |
19:21 |
|
3 |
Pouch |
21:12 |
21:12 |
|
4 |
Pouch |
21:41 |
21:41 |
|
5 |
Cylindrical |
43:06 |
43:06 |
|
6 |
NCA |
Cylindrical |
32:31 |
32:57 |
|
7 |
Cylindrical |
38:27 |
38:27 |
|
8 |
LFP |
Pouch |
21:48 |
21:48 |
ÝîîýÜ░ý╣śÝśĽ Ű░░Ýä░ŰŽČŰŐö Ű▓ĄÝŐŞ Ű░ťýâŁŕ│╝ ŕ▒░ýŁś ŰĆÖýőťýŚÉ ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁÝĽśýśÇýžÇŰžî, 1ý░Ę ýőĄÝŚśýŁŞ ŕ░üÝśĽ Ű░░Ýä░ŰŽČýÖÇ 7ý░Ę ýőĄÝŚśýŁŞ ýŤÉÝćÁÝśĽ Ű░░Ýä░ŰŽČýŚÉýäťŰŐö Ű▓ĄÝŐŞŕ░Ç Ű░ťýâŁŰÉśŕ│á ýŁ╝ýἠýőťŕ░ä ýŁ┤ÝŤäýŚÉ ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťý⣠ŰÉśýŚłŰőĄ. 1Űę┤ýŁä ۬ĘŰĹÉ Ý׳ÝîůÝĽśŰŐö ÝîîýÜ░ý╣śÝśĽŕ│╝ŰŐö ŰőČŰŽČ ýĽäŰל Űę┤Űžî ŕ░ÇýŚ┤ŰÉśŰŐö ŕ░üÝśĽŕ│╝ ýŤÉÝćÁÝśĽýŁÇ ýĽäŰלŰę┤ýŁś ýÜ░ýäáýáüýŁŞ ýśĘŰĆä ýâüýŐ╣ýť╝Űíť ýŁŞÝĽť ýĽĽŰáą ŰÂäýÂť ýŁ┤ÝŤä ŕ░ťŰ░ęŰÉť ŰÂÇŰÂäýŁä ÝćÁÝĽť ýŤÉÝ֝ݼť ýé░ýćî ŕ│ÁŕŞë Ű░Ć ýÂöŕ░ÇýáüýŁŞ ýŚ┤ ýáäýŁ┤ Űô▒ýŁś ýśüÝľąýť╝Űíť ýŚ┤ÝĆşýú╝ŕ░Ç ýőťŕ░ä ý░ĘŰą╝ ŰĹÉŕ│á ÝÖťýä▒ÝÖöŰÉá ýłś ý׳ŰŐö ŕ░ÇŰŐąýä▒ýŁä ýáťŕŞ░ÝĽá ýłś ý׳ŰőĄ.
ŰśÉÝĽť, ýŤÉÝćÁÝśĽýŁś ŕ▓ŻýÜ░ýŚÉŰŐö ýâüŰîÇýáüýť╝Űíť Ýü░ ýÜęŰčëýŚÉýäť ýőťŕ░ä ý░Ęŕ░Ç Ű░ťýâŁŰÉśýŚłŰŐöŰŹ░, ýŁ┤ŰŐö ý×ĹýŁÇ ýÜęŰčëŰ│┤ŰőĄ Ýü░ ýÜęŰčëýŚÉýäť ýŚ┤ÝĆşýú╝ŰíťýŁś ýáäýŁ┤ŕ░Ç ýľ┤ŰáĄýÜŞ ýłś ý׳ýŁîýŁä ýâŁŕ░üÝĽ┤ Ű│╝ ýłś ý׳ŰőĄ.
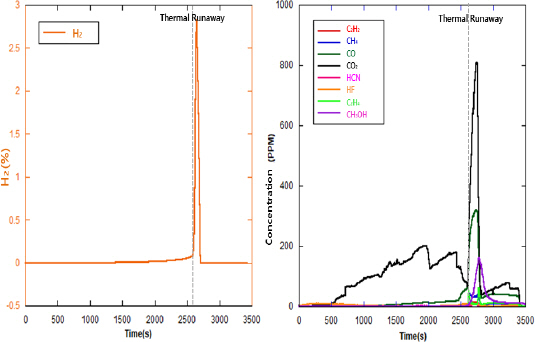
Figure 3ýŁÇ 1ý░Ę ýőĄÝŚśýť╝Űíť NCM ŕ│äýŚ┤ýŁś ŕ░üÝśĽ Ű░░Ýä░ŰŽČýŁś ýŚ┤ÝîÉ ŕ░ÇýŚ┤ ýőť Ű░ťý⣠ŰÉť ýśĘŰĆä Ű░Ć ýłśýćî ŰćŹŰĆäýŁś Ű│ÇÝÖöŰą╝ ŰéśÝâÇŰéŞ ŕĚŞŰלÝöäýŁ┤Űę░, ýÖ╝ý¬Ż ŕĚŞŰלÝöäŰŐö ýśĘŰĆä, ýśĄŰąŞý¬Ż ŕĚŞŰלÝöäŰŐö ýłśýćî ŰćŹŰĆäŰą╝ ŰéśÝâÇŰéŞŰőĄ. ýśĘŰĆäŰą╝ ýŞíýáĽÝĽśŕŞ░ ýťäÝĽť ýŚ┤ýáäŰîÇŰŐö ýůÇ ýáäŰę┤, ýŞíŰę┤, ýâüŰőĘýŁś Ű░░ýÂťŰ│ÇýŚÉ ýäĄý╣śŰÉśýŚłŰőĄ.
Figure 3
Temperature changes at 3 points and hydrogen concentration change in chamber (1st).

ýőĄÝŚś ýőťý×Ĺ ÝŤä ýĽŻ 2,400 sŕ░Ç ŕ▓Żŕ│╝ÝĽť ýőťýáÉýŚÉ ýŚ┤ÝĆşýú╝ ýŁ┤ýáäýŚÉ Ű░░ýÂťŰ│ÇýŚÉýäť Ű▓ĄÝŐŞ ŕ░ÇýŐĄŰą╝ ŰÂäýݼśýśÇŰőĄ. ŕ░ÇýŐĄŕ░Ç ŰÂäýÂťŰÉśŕ│á ýĽŻ 7 s ÝŤä ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉśýŚłŰőĄ. ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőť ŕŞëŕ▓ęÝĽť ÝÖöýŚ╝ Ű░ťýâŁŕ│╝ ÝĽĘŕ╗ś Ű░░ýÂťŰ│ÇýŁś ýśĘŰĆäŰŐö ŕŞëŕ▓ęÝĽśŕ▓î ýâüýŐ╣ÝĽśýŚČ ýĽŻ 540 ┬░Cŕ╣îýžÇ ŰĆäŰőČÝĽśýśÇŕ│á, ýŁ┤ ýžÇýáÉýŚÉýäť ýłśýćî ŰćŹŰĆä ŰśÉÝĽť ŕŞëŕ▓ęÝĽśŕ▓î ýŽŁŕ░ÇÝĽśýŚČ ýĽŻ 3%ýŚÉ ŰĆäŰőČÝĽśýśÇŰőĄ.
Figure 4ŰŐö 1ý░Ę ýőĄÝŚś ýőť FT-IRýŁä ýéČýÜęÝĽśýŚČ ý▒öŰ▓ä Űé┤ŰÂÇýŚÉýäť Ű░ťý⣠ŰÉť ýŁ┤ýé░ÝÖöÝâäýćî, ýŁ╝ýé░ÝÖöÝâäýćî, ýĽäýäŞÝőŞŰáî, ýŚÉÝőŞŰáî, ŰęöÝâä Űô▒ ŕ░üýóů ŕ░ÇýŐĄ ŰćŹŰĆäýŁś Ű│ÇÝÖöŰą╝ ŰéśÝâÇŰéŞ ŕĚŞŰלÝöäýŁ┤ŰőĄ.
ÝĽ┤Űő╣ ýőĄÝŚśŰ┐ÉŰžî ýĽäŰőłŰŁ╝, ŕŞ░ÝâÇ ýőĄÝŚśýŚÉýäťŰĆä Ű▓ĄÝŐŞ Ű░ťý⣠ýőť ýŁ┤ýé░ÝÖöÝâäýćî Ű░Ć ýŁ╝ýé░ÝÖöÝâäýćîýŁś ŰćŹŰĆäŰŐö ýĽŻ 400 ppm ýłśýĄÇýť╝Űíť ýŞíýáĽŰÉśýľ┤ Ű╣äýŐĚÝĽť ýłśýĄÇýŁä ŰéśÝâÇŰé┤Űę░, ýŁ┤ŰŐö Ű░░Ýä░ŰŽČ Űé┤ŰÂÇ ŕ│╝ýŚ┤ Ű░Ć ýé░ýćî ŕ│ÁŕŞë ŰÂÇýí▒ýť╝Űíť ýŁŞÝĽť ŰÂłýÖäýáä ýŚ░ýćîýŁś ŕ▓░ŕ│╝Űíť ýâŁŕ░üŰÉťŰőĄ.
Figure 4
Gas concentration changes in chamber (1st).
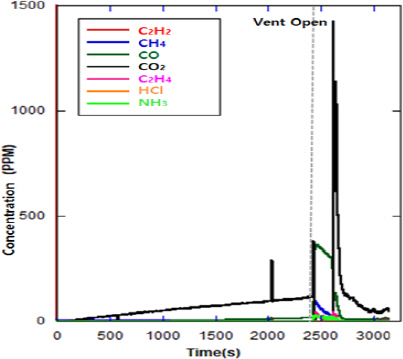
ýŚ┤ÝĆşýú╝ ýŁ┤ÝŤäýŁś ýŁ╝ýé░ÝÖöÝâäýćîýŁś ŰćŹŰĆäŰŐö ŕ░ÉýćîÝĽśŕ│á ýŁ┤ýé░ÝÖöÝâäýćîýŁś ŰćŹŰĆäŰŐö ŕŞëŕ▓ęÝĽśŕ▓î ýâüýŐ╣ÝĽśŰŐö ŕ▓âýŁä ÝÖĽýŁŞÝĽá ýłś ý׳ýŚłŰőĄ.
ýŁ┤ýé░ÝÖöÝâäýćî Ű░Ć ýŁ╝ýé░ÝÖöÝâäýćî ýÖŞ ŕŞ░ÝâÇ ŕ░ÇýŐĄýŁś ŰćŹŰĆäŰŐö ۬ĘŰĹÉ 150 ppm Ű»ŞŰžî ýłśýĄÇýť╝Űíť ŰéśÝâÇŰéČŰőĄ. ýŚ┤ÝĆşýú╝ ýőť ýŚÉÝőŞŰáîýŁÇ ýĽŻ 130 ppm, ŰęöÝâäýŁÇ ýĽŻ 100 ppm, ýĽäýäŞÝőŞŰáîýŁÇ ýĽŻ 40 ppm ýłśýĄÇŕ╣îýžÇ ŰĆäŰőČÝľłŰőĄŕ░Ç ŰőĄýőť ŕ░ÉýćîÝĽśýśÇŰőĄ. ŕŞ░ÝâÇ ŕ░ÇýŐĄýŁś ŰćŹŰĆäŰŐö 30 ppm Ű»ŞŰžî ýłśýĄÇýŁ┤ýŚłŰőĄ.
Figure 5ŰŐö NCM ŕ│äýŚ┤ ÝîîýÜ░ý╣śÝśĽ(30 Ah) Ű░░Ýä░ŰŽČŰą╝ ýŚ┤ÝîÉ ŕ░ÇýŚ┤ÝĽť 4ý░Ę ýőĄÝŚś ýőť Ű░ťý⣠ŰÉť ýśĘŰĆäýŁś Ű│ÇÝÖöŰą╝ ŰéśÝâÇŰéŞ ŕĚŞŰלÝöäýŁ┤ŰőĄ. 4ý░Ę ýőĄÝŚśýŚÉýäťŰŐö ýĽŻ 1,300 sýŚÉýäť ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉśýŚłýť╝Űę░, 2~3ý░Ę ýőĄÝŚśýŚÉýäťŰŐö ýĽŻ 1,300 s Ű»ŞŰžîýŁś ýťáýéČÝĽť ýőťŕ░äŰîÇýŚÉ ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉśýŚłŰőĄ.
Figure 5
Temperature changes at 2 points (4th).
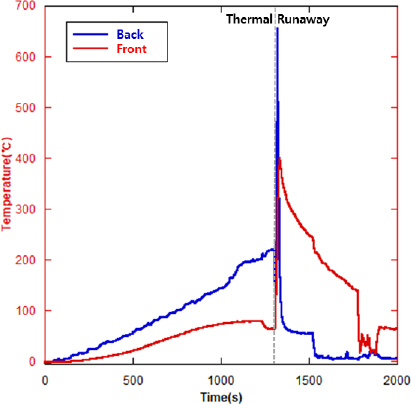
Figure 6ýŁÇ ýőĄÝŚś ýőť Ű░ťýâŁŰÉť Off-gasýÖÇ ýŚ┤ÝĆşýú╝Űą╝ ŕ░üŕ░ü Ű│┤ýŚČýú╝ŕ│á ý׳ýť╝Űę░, Ű▓ĄÝŐŞýÖÇ ýŚ┤ÝĆşýú╝ŕ░Ç ýőťý░ĘŰą╝ ŰĹÉŕ│á Ű░ťýâŁŰÉá ŕ▓ŻýÜ░ýŚÉŰŐö (a)ýÖÇ ŕ░ÖýŁ┤ ŰĘ╝ýáÇ ŕ░ÇýŐĄŰą╝ ŰÂäýݼśŕ│á, ýŁ┤ÝŤäýŚÉ (b)ýÖÇ ŕ░ÖýŁ┤ ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉťŰőĄ.
Figure 6
Venting and thermal runaway.

NCM ŕ│äýŚ┤ ÝîîýÜ░ý╣śÝśĽ Ű░░Ýä░ŰŽČŰą╝ ýŚ┤ÝîÉ ŕ░ÇýŚ┤ÝĽť 2, 3, 4ý░Ę(ŕ░ü 63, 70, 30 Ah) ýőĄÝŚśýŚÉýäť ýŚ┤ÝĆşýú╝ýŚÉ Űö░ŰąŞ ýůÇ ýáäŰę┤ŕ│╝ ÝŤäŰę┤ýŁś ýśĘŰĆä Ű│ÇÝÖöŰŐö ŕ░ü ýőĄÝŚśŰ│äŰíť ýŁ╝ŰÂÇ ýőťŕ░ä ý░ĘŰŐö Ű░ťýâŁÝĽśýśÇýžÇŰžî ŕĚŞ ýä▒ýâüýŁÇ ýťáýéČÝĽśŕ▓î ŰéśÝâÇŰéČŰőĄ. ýůÇýŁś ýśĘŰĆäŰŐö ýŁ╝ýáĽÝĽśŕ▓î ýŽŁŕ░ÇÝĽśŰőĄŕ░Ç ýŁ╝ýἠýőťŕ░ä ýáĽý▓┤ŕŞ░Űą╝ ŕ▒░ý╣ť ÝŤä ýŚ┤ÝĆşýú╝ ýőť ýśĘŰĆäŕ░Ç ŕŞëŕ▓ęÝĽśŕ▓î ýâüýŐ╣ÝľłŰőĄŕ░Ç ÝĽśŕ░ĽÝĽśŰŐö ÝŐ╣ýä▒ýŁä ŰéśÝâÇŰâłŰőĄ.
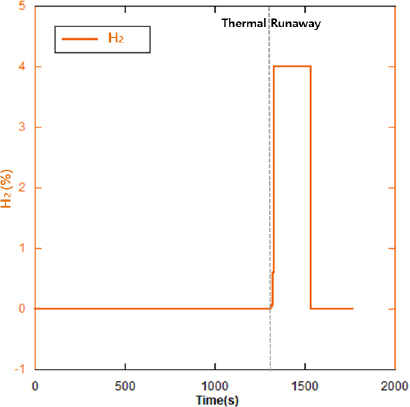
ýłśýćîŰŐö 2~4ý░Ę ýőĄÝŚśýŚÉýäť Ű¬ĘŰĹÉ 4%Űą╝ ŰéśÝâÇŰâłýť╝Űę░, 4ý░Ę ýőĄÝŚśýŁś ŕ▓ŻýÜ░
Figure 5ýŁś ŕĚŞŰלÝöäýÖÇ ŕ░ÖýŁ┤ ýŚ┤ÝĆşýú╝ŕ░Ç ýĽŻ 1,320 sŰÂÇÝä░ Ű░ťýâŁÝĽśýśÇŰőĄ. ýŚ┤ÝĆşýú╝ ýőť ýůÇýŁś ýŞíŰę┤ýŁ┤ ŕ░ťŰ░ęŰÉśŰę┤ýäť ýůÇ Űé┤ŰÂÇýŚÉýäť ýâŁýä▒ŰÉť ŕ░ÇýŐĄŕ░Ç ŰÂäýÂťŰÉśýŚłŕ│á,
Figure 7ŕ│╝ ŕ░ÖýŁ┤ ýŚ┤ÝĆşýú╝ ýőťýáÉýŁŞ ýĽŻ 1,320 sŰÂÇÝä░ ŕŞëŕ▓ęÝĽśŕ▓î ŰćŹŰĆäŕ░Ç ýâüýŐ╣ÝĽśýŚČ 1,330~ 1,534 s ŕÁČŕ░äýŚÉýäť 204 sŰĆÖýĽł Peak ŕ░ĺ(4%)ýŁä ŰéśÝâÇŰâłŰőĄ.
Figure 7
Hydrogen concentration change (4th).
2~4ý░Ę ýőĄÝŚśýŁä ýáťýÖŞÝĽť ŕŞ░ÝâÇ Ű¬ĘŰôá ýőĄÝŚśýŚÉýäť ýłśýćî Ű░ťýâŁŰčëýŁÇ 3% ýŁ┤Űé┤Űíť ÝĽ┤Űő╣ ýőĄÝŚśýŚÉýäť ýłśýćî ŰćŹŰĆäŰŐö ŕ░Çý׹ ŰćĺýĽśŰőĄ. ŰśÉÝĽť, ýłśýćî ýŞíýἠý׹ý╣śýŁś ýŞíýἠýÁťŰîÇ ŕ░ĺýŁ┤ 4%Űíť ýőĄýáťŰíťŰŐö ýŁ┤Ű│┤ŰőĄ ŰćĺýŁä ŕ▓âýť╝Űíť ýśłýâüŰÉťŰőĄ.
1ý░Ę ýőĄÝŚśŕ│╝ Űžłý░Čŕ░ÇýžÇŰíť 2~4ý░Ę ýőĄÝŚśýŚÉýäťŰĆä ýŁ┤ýé░ÝÖöÝâäýćîŕ░Ç ŕ░Çý׹ ŰžÄýŁ┤ Ű░ťýâŁŰÉśýŚłŕ│á, ýŁ╝ýé░ÝÖöÝâäýćîŕ░Ç ŰĺĄŰą╝ ýŁ┤ýŚłŰőĄ. ŰőĘ, ýŁ┤ýé░ÝÖöÝâäýćîýÖÇ ýŁ╝ýé░ÝÖöÝâäýćîŰą╝ ýáťýÖŞÝĽť ŕŞ░ÝâÇ ŕ░ÇýŐĄ ýĽäýäŞÝőŞŰáî, ýŚÉÝőŞŰáî, ŰęöÝâä Űô▒ýŁś Hydrocarbon ŕ│äýŚ┤ýŁś ŕ░ÇýŐĄ ýí░ýä▒Ű╣äŰŐö ýőĄÝŚś Ű│äŰíť ýŁ╝ŰÂÇ ý░ĘýŁ┤Űą╝ ŰéśÝâÇŰé┤ýŚłŰőĄ.
Figure 8ýŚÉýäť ýŚ┤ÝĆşýú╝ ýőť ýŁ┤ýé░ÝÖöÝâäýćîýÖÇ ýŁ╝ýé░ÝÖöÝâäýćîŕ░Ç ŕŞëŕ▓ęÝĽśŕ▓î ýŽŁŕ░ÇÝĽśŰŐö ŕ▓âýŁä ÝÖĽýŁŞÝĽá ýłś ý׳ŰőĄ. ýŚ┤ÝĆşýú╝ ýőťýáÉýŚÉ ýŁ┤ýé░ÝÖöÝâäýćîŕ░Ç ŰőĄŰčë Ű░░ýÂťŰÉśŕ│á ýłťŕ░ä ŕ░ÉýćîÝĽśýśÇŰőĄŕ░Ç ýŚ┤ÝĆşýú╝ŕ░Ç ŰüŁŰéá ŰĽîŕ╣îýžÇ ŰőĄýőť ࿪ýĄÇÝ׳ ýŽŁŕ░ÇÝĽśŰŐö ýÂöýäŞŰą╝ Ű│┤ýśÇŰőĄ. ýŁ╝ýé░ÝÖöÝâäýćîŰŐö ýŚ┤ÝĆşýú╝ ýőťýáÉŰÂÇÝä░ ࿪ýĄÇÝĽśŕ▓î ŕ░ÉýćîÝĽśŰŐö ýÂöýäŞŰą╝ Ű│┤ýśÇŰőĄ.
Figure 8
Gas concentration changes in chamber (4th).

Figure 9ŰŐö 5ý░Ę ýőĄÝŚś ýőť Ű░ťý⣠ŰÉť ýśĘŰĆäýŁś Ű│ÇÝÖöŰą╝ ŰéśÝâÇŰé┤ŕ│á ý׳ŰŐöŰŹ░, ýŤÉÝćÁÝśĽ Ű░░Ýä░ŰŽČ 10ŕ░ťŰą╝ 5ŕ░ťýöę 2ýŚ┤Űíť ýáĽŰáČýőťÝéĄŕ│á ŕ░ü ýŚ┤ýŁś ŕ░ÇýÜ┤ŰŹ░ýŚÉ Ű░░ý╣ś(5ŕ░ť ýĄĹ 3Ű▓łýžŞ)ŰÉť ýůÇýŚÉ ýŚ┤ýáäŰîÇŰą╝ ŰÂÇý░ęÝĽśýŚČ ýśĘŰĆäŰą╝ ýŞíýáĽÝĽśýśÇŰőĄ. ýŚ┤ÝĆşýú╝ŰŐö ýĽ×ýäá ýőĄÝŚśŰôĄŰ│┤ŰőĄ ŰŐŽŕ▓î Ű░ťýâŁÝĽśýśÇŰŐöŰŹ░, ýĽ×ýäť ýäĄŰ¬ůÝĽť ŕ▓âŕ│╝ ŕ░ÖýŁ┤ ŕ░ÇýŚ┤ ýőť ýŚ┤ÝîÉýŚÉ Űő┐ŰŐö Űę┤ýáüýŁ┤ ýáüýŁÇ ýśüÝľąýŁ┤ ý׳ŰŐö ŕ▓âýť╝Űíť ýâŁŕ░üŰÉťŰőĄ.
Figure 9
Temperature changes at 2 points (5th).
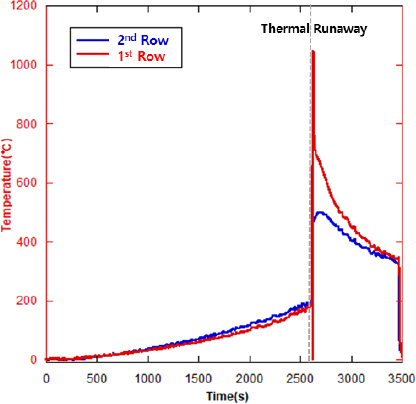
Figure 10ýŁÇ 5ý░Ę ýőĄÝŚś ýőť Ű░ťý⣠ŰÉť ýłśýćî Ű░Ć ŕŞ░ÝâÇ ŕ░ÇýŐĄýŚÉ ŰîÇÝĽť ŕĚŞŰלÝöäýŁ┤ŰőĄ. ýŚ┤ÝĆşýú╝ ýőť ýłśýćî Ű░Ć ŕŞ░ÝâÇ ŕ░ÇýŐĄ ŰćŹŰĆäŕ░Ç Ýśäŕ▓ęÝ׳ ýŽŁŕ░ÇÝĽśýśÇŰŐöŰŹ░, ýŤÉÝćÁÝśĽ Ű░░Ýä░ŰŽČŰŐö ýůÇ Ű│ä ýłśýŚ┤ ý░ĘýŁ┤ Űô▒ýť╝Űíť ýŁŞÝĽśýŚČ 10ŕ░ťýŁś ýůÇýŁ┤ ÝĽťŕ║╝Ű▓łýŚÉ ýŚ┤ÝĆşýú╝ ŰÉśýžÇ ýĽŐŕ│á ýőťŕ░ä ý░ĘŰą╝ ŰĹÉŕ│á ŕ░üŕ░ü Ű░ťýâŁŰÉťŰőĄ.
Figure 10
Hydrogen and gas concentration changes in chamber (5th).
ýŁ╝ýἠýőťŕ░äýŁä ŰĹÉŕ│á ýŚ░ýćîŰą╝ ÝĽśŰŐö ŕ░üÝśĽ Ű░Ć ÝîîýÜ░ý╣śÝśĽ Ű░░Ýä░ŰŽČýÖÇŰŐö ŰőČŰŽČ, ýőťŕ░ä ý░ĘŰą╝ ŰĹÉŕ│á ŕ░üŕ░ü ÝĆşŰ░ťÝĽśŰę░ ŕ░ÇýŐĄŰą╝ ŰÂäýÂťýőťÝéĄŰŐö ÝŐ╣ýä▒ ŰĽîŰČŞýŚÉ ý▒öŰ▓ä Űé┤ŰÂÇýŁś ŕ░ÇýŐĄ ŰćŹŰĆäŰŐö ýŚ┤ÝĆşýú╝ ŰĆÖýĽł ŕ░Éýćî ýŚćýŁ┤ Űé┤Űé┤ ýŽŁŕ░ÇÝĽśŰŐö ÝśĽÝâťŰą╝ ŰŁáŰŐö ŕ▓âýť╝Űíť Ű│┤ýŁŞŰőĄ. ýŤÉÝćÁÝśĽ Ű░░Ýä░ŰŽČ 10ŕ░ť ýĄĹ ŕ░Çý׹ ý▓śýŁî ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉśýľ┤ ŕ░ÇýŐĄŕ░Ç Ű│Şŕ▓ęýáüýť╝Űíť Ű░░ýÂťŰÉśŕŞ░ ýőťý×ĹÝĽť ýőťŕ░äýŁÇ ýĽŻ 2,620 sýŁ┤ŕ│á, 2,647 sŕ╣îýžÇ ýžÇýćŹýáüýť╝Űíť ýŽŁŕ░ÇÝĽť ýŁ┤ÝŤä 2,648 sŰÂÇÝä░ ŰőĄýőť ŕ░ÉýćîÝĽśýśÇŰőĄ.
ýŽë, ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁÝĽśŕ│á 27 s ŰĆÖýĽłýŁÇ ýŁ┤ýé░ÝÖöÝâäýćî, ýŁ╝ýé░ÝÖöÝâäýćî Ű░Ć ŰęöÝâäýśČ Űô▒ 5ý░Ę ýőĄÝŚśýŚÉýäť Ű░ťýâŁÝĽť ŕ░ÇýŐĄ ýĄĹ ŰćĺýŁÇ Ű╣äýťĘýŁä ý░ĘýžÇÝĽśŰŐö ýú╝ýÜö ŕ░ÇýŐĄŕ░Ç Ű¬ĘŰĹÉ ýŽŁŕ░ÇÝĽśŰŐö ýÂöýäŞŰą╝ Ű│┤ýśÇŰőĄ. Űö░ŰŁ╝ýäť, ýŁ╝ýé░ÝÖöÝâäýćî ŰśÉÝĽť ý▓ź ŕ░ÇýŐĄ Ű▓ĄÝŐŞ ýŁ┤ÝŤä ŕ░ü ýůÇ Ű│äŰíť ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁÝĽśýŚČ 10Ű▓łýžŞ ýŚ┤ÝĆşýú╝ Ű░ťýâŁýŁ┤ ŰüŁŰéá ŰĽîŕ╣îýžÇ 27 s ŰĆÖýĽł ý▒öŰ▓ä Űé┤ýŚÉ ŰłäýáüŰÉť ŕ▓âýť╝Űíť ýâŁŕ░üŰÉťŰőĄ.
6~7ý░Ę ýőĄÝŚś ŕ▓░ŕ│╝ŰŐö
Figure 9ýŁś 5ý░Ę ýőĄÝŚś ýőť ýśĘŰĆä Ű│ÇÝÖöýÖÇ ýťáýéČÝĽśŕ▓î ŰéśÝâÇŰéČýť╝Űę░, ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőťŕ░äýŚÉŰžî ýŁ╝ŰÂÇ ý░ĘýŁ┤ŕ░Ç ýí┤ý×ČÝĽśýśÇŰőĄ. 6~7ý░Ę ýőĄÝŚśýŁś ýőťŰúîŰíť ýéČýÜęŰÉť NCA ŕ│äýŚ┤ ýŤÉÝćÁÝśĽ Ű░░Ýä░ŰŽČŰŐö 5ý░Ę ýőĄÝŚśýŁś ýőťŰúîŰíť ýéČýÜęŰÉť NCM ŕ│äýŚ┤ ýŤÉÝćÁÝśĽ Ű░░Ýä░ŰŽČŰ│┤ŰőĄ ŰĘ╝ýáÇ ýŚ┤ÝĆşýú╝ŕ░Ç Ű░ťýâŁŰÉĘýŁä ÝÖĽýŁŞÝĽá ýłś ý׳ýŚłŰőĄ. ýŚČŕŞ░ýäť ýľĹŕĚ╣ý×ČýŁś ýĽłýáĽýä▒ŕ│╝ ýŚ┤ÝĆşýú╝ ýőťŕ░ä ŕ░äýŁś ŕ┤Çŕ│ä ŰśÉÝĽť ýťáýÂöÝĽ┤Ű│╝ ýłś ý׳ŰőĄ.
Figure 11ýŁÇ NCA ŕ│äýŚ┤ ýŤÉÝćÁÝśĽ(5 Ah) Ű░░Ýä░ŰŽČŰą╝ ýŚ┤ÝîÉ ŕ░ÇýŚ┤ÝĽť 7ý░Ę ýőĄÝŚś ýőť Ű░ťý⣠ŰÉť ýłśýćî Ű░Ć ŕŞ░ÝâÇ ŕ░ÇýŐĄýŚÉ ŰîÇÝĽť ŕĚŞŰלÝöäýŁ┤ŰőĄ. ýŁ┤ýáä ýőĄÝŚśŕ│╝ ŰĆÖýŁ╝ÝĽśŕ▓î ýŚ┤ÝĆşýú╝ýÖÇ ŰĆÖýőťýŚÉ ýłśýćî Ű░Ć ŕŞ░ÝâÇ ŕ░ÇýŐĄ ŰćŹŰĆäŕ░Ç ÝśäýáÇÝ׳ ýŽŁŕ░ÇÝĽśýśÇýŁîýŁä ÝÖĽýŁŞÝĽá ýłś ý׳ýŚłýť╝Űę░, ýłśýćî ŰćŹŰĆäŰŐö ýĽŻ 1.5%ýŚÉ ۬╗ Ű»Şý│Ąŕ│á ŕŞ░ÝâÇ ŕ░ÇýŐĄýŁś ŰćŹŰĆäŰŐö ýŁ┤ýé░ÝÖöÝâäýćî, ýŁ╝ýé░ÝÖöÝâäýćî, ŰęöÝâäýśČ, ŕŞ░ÝâÇ ýłťýŁ┤ýŚłŰőĄ.
Figure 11
Hydrogen and gas concentration changes in chamber (7th).
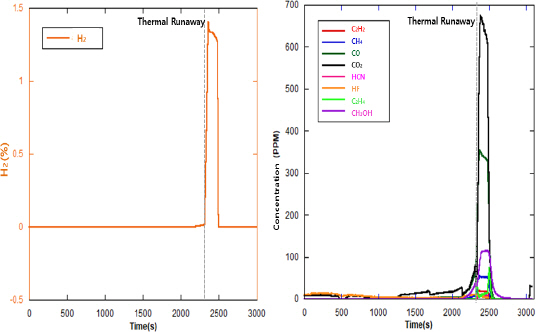
Table 2ýŁś ýőĄÝŚś ŕ▓░ŕ│╝ýŚÉýäť 8ý░Ę ýőĄÝŚśýŁś ýőťŰúîýŁŞ ÝîîýÜ░ý╣śÝśĽ LFP ŕ│äýŚ┤ýŁś ýŚ┤ÝĆşýú╝ŰŐö 1,308 sýŚÉ Ű░ťýâŁŰÉśýŚłýť╝Űę░, 2ý░ĘŰÂÇÝä░ 4ý░Ę ýőĄÝŚśŕ╣îýžÇýŁś ýőťŰúîýŁŞ ÝîîýÜ░ý╣śÝśĽ NCM ŕ│äýŚ┤Ű│┤ŰőĄ ŰŐŽŕ▓î Ű░ťýâŁŰÉśýŚłŰőĄ. LFP ŕ│äýŚ┤ Ű░░Ýä░ŰŽČýŁś ýŚ┤ÝĆşýú╝ŰŐö NCM ŕ│äýŚ┤ Ű░░Ýä░ŰŽČŰ│┤ŰőĄ ýáüŕ▓îŰŐö 7 sýŚÉýäť ŰžÄŕ▓îŰŐö 147 s ŕ░ÇŰčë ŰŐŽŕ▓î Ű░ťýâŁÝĽśýśÇŰőĄ. ýŁ┤ŰčČÝĽť ýőĄÝŚś ŕ▓░ŕ│╝Űíť ýśČŰŽČŰ╣łŕ│ä ýľĹŕĚ╣ý×ČýŁŞ LFPŕ░Ç NCMŰ│┤ŰőĄ ýĽłýáĽýä▒ýŁä ŰéśÝâÇŰé┤ŕ│á P=O ŕ│Áýťáŕ▓░ÝĽęýŁś ŕ▓░ÝĽęŰáą Űô▒ ÝÜĘŕ│╝Űą╝ ýőĄÝŚśýáüýť╝Űíť ýŽŁŰ¬ůÝĽ┤Ű│╝ ýłś ý׳ýŚłŰőĄ.
5. HFýÖÇ H2ýŁś ŕ┤Çŕ│ä
HFŰŐö ýŚ┤ÝĆşýú╝ ýőť Ű░ťý⣠ŰÉśŰŐö ýáäý▓┤ ŕ░ÇýŐĄ Ű░ťýâŁŰčë ýĄĹ ý░ĘýžÇÝĽśŰŐö Ű╣äýťĘýŁÇ ŰžĄýÜ░ ýáüýŁÇ ÝÄŞýŁ┤ýžÇŰžî ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŚÉýäť Ű░ťý⣠ŰÉśŰŐö ŰîÇÝĹťýáüýŁŞ ŰĆůýä▒ŕ░ÇýŐĄŰíť ýŁŞý▓┤ýŚÉ ŰžĄýÜ░ ý╣śŰ¬ůýáüýŁ┤ŰőĄ. ŰśÉÝĽť H2ŰŐö ÝĆşŰ░ť Ű▓öýťäŕ░Ç 4~74%Űíť ŰžĄýÜ░ Űäôýľ┤ Ű░ťý⣠ýőť ýéČŕ│á ýťäÝŚśýä▒ýŁ┤ ÝüČŰőĄ. Űö░ŰŁ╝ýäť, ýŁ┤ ŰĹÉ ŕ░ÇýžÇ ŕ░ÇýŐĄŰŐö ýĽłýáäŰîÇý▒ůýŁä ýťäÝĽśýŚČ ÝîîýĽůÝĽśýŚČýĽ╝ ÝĽá ýĄĹýÜöÝĽť ýÜöýćîýŁ┤ŰőĄ.
Table 3ýŁÇ HFýÖÇ H
2 ŕ░ÇýŐĄŰą╝ ŰĆÖýőťýŚÉ ýŞíýáĽÝĽť 4ÝÜîýŁś ýőĄÝŚś ŕ▓░ŕ│╝Űą╝ ýáĽŰŽČÝĽť ÝĹťýŁ┤ŰőĄ. ŕŞ░Ű│Şýáüýť╝Űíť NCM ŕ│äýŚ┤ýŁś Ű░░Ýä░ŰŽČýŚÉýäť HFýŁś Ű░ťýâŁŰčëýŁ┤ ŕ░Çý׹ ýáüýŚłŕ│á, NCA ŕ│äýŚ┤ýŁś Ű░░Ýä░ŰŽČŕ░Ç NCM ŕ│äýŚ┤Ű│┤ŰőĄ HF Ű░ťýâŁŰčëýŁ┤ ŰŹö ŰžÄýĽśýť╝Űę░, LFP ŕ│äýŚ┤ Ű░░Ýä░ŰŽČýŚÉýäť HF Ű░ťýâŁŰčëýŁ┤ ŕ░Çý׹ ŰžÄýŁÇ ŕ▓âýŁä ýĽî ýłś ý׳ýŚłŰőĄ. ŰśÉÝĽť, H
2 Ű░ťýâŁŰčëýŁÇ HFýŁś Ű░ťýâŁŰčëŕ│╝ Ű░śŰ╣äŰíÇÝĽĘýŁä ÝÖĽýŁŞÝĽá ýłś ý׳ýŚłŰőĄ.
Table 3
Results of the Experiment
|
No. |
Cathod |
Type |
HF (ppm) |
H2 (vol %) |
Time to TR (s) |
|
1 |
NCM |
Pouch |
3.299 |
4 |
21:41 |
|
2 |
Cylindrical |
9.979 |
2.829 |
43:06 |
|
3 |
NCA |
Cylindrical |
14.557 |
1.404 |
38:27 |
|
4 |
LFP |
Pouch |
31.127 |
0.966 |
21:48 |
ýŁîŕĚ╣ý×ČýŁś binderýŚÉ ýéČýÜęŰÉśŰŐö ýú╝ýÜö ŰČ╝ýžł ýĄĹ ÝĽśŰéśŰíť polyvinylidene fluoride (PVDF)ŕ░Ç ý׳ŰőĄ. ýśĘŰĆä 260 ┬░C ýŁ┤ýâü Űô▒ ÝŐ╣ýἠýí░ŕ▒┤ýŚÉýäť, Ýâäýćî ýŁîŕĚ╣ýŚÉ ŰŽČÝŐČýŁ┤ýśĘýŁ┤ ýéŻý×ůŰÉť ýâüÝâťŰíť PVDF (-CH
2-CF
2-)ŕ░Ç Ű░śýŁĹÝĽśŕ▓î ŰÉśŰę┤ HFŰ┐ÉŰžî ýĽäŰőłŰŁ╝, H
2ŕ░Ç ŰőĄýŁîŕ│╝ ŕ░ÖýŁ┤ Ű░ťý⣠ŰÉťŰőĄ(
11).
ýőŁ(1)ŕ│╝ (2)ýÖÇ ŕ░ÖýŁ┤ PVDFŰíťŰÂÇÝä░ HFýÖÇ H2ŕ░Ç Ű░ťýâŁŰÉśŰŐöŰŹ░, HF ŕ░ÇýŐĄ Ű░ťýâŁýŁ┤ ŰžÄýť╝Űę┤ ýłśýćî Ű░ťýâŁŰčëýŁ┤ ýáüýŁîýŁä ýťä ÝÖöÝĽÖýőŁýť╝Űíť ýťáýÂöÝĽ┤ Ű│╝ ýłś ý׳ŰőĄ.
ŰśÉÝĽť, ŰŽČÝŐČýŁ┤ýśĘýŁ┤ PVDFýŁś Ű░śýŁĹýŚÉ ŕ┤ÇýŚČÝĽá ŕ▓ŻýÜ░, ýőŁ(2)ýÖÇ ŕ░ÖýŁ┤ ýłśýćîŕ░Ç Ű░ťýâŁŰɜۻÇŰíť ýŁîŕĚ╣ýŚÉ ŰŽČÝŐČýŁ┤ýśĘýŁ┤ ŰžÄýŁ┤ ýí┤ý×ČÝĽáýłśŰíŁ, ýŽë, SOCŕ░Ç ŰćĺýŁäýłśŰíŁ H2ŕ░Ç ŰžÄýŁ┤ Ű░ťýâŁŰÉśŕ│á HFŰŐö ýáüŕ▓î Ű░ťý⣠ŰÉá ŕ░ÇŰŐąýä▒ ŰśÉÝĽť ýâŁŕ░üÝĽ┤ Ű│╝ ýłś ý׳ŰőĄ.
Table 3ýŁś HFýÖÇ H
2ýŁś Ű░ťýâŁŰčëýŁä ýé┤ÝÄ┤Ű│┤Űę┤, ýőĄýáťŰíťŰĆä Ű░śŰ╣äŰíÇ ŕ┤Çŕ│äýŚÉ ý׳ýŁîýŁä ýžüŕ┤Çýáüýť╝ŰíťŰĆä ýĽî ýłś ý׳ýť╝Űę░, PearsonýŁś ýâüŕ┤Çŕ│äýłśŰŐö -0.886ýŁ┤ ŰĆäýÂťŰÉśýľ┤ ŕ░ĽŰáąÝĽť ýŁî(-)ýŁś ýâüŕ┤ÇýŁ┤ ý׳ýŁîýŁä ÝćÁŕ│äýáüýť╝ŰíťŰĆä ýÂöŰíáÝĽá ýłś ý׳ýŚłŰőĄ. HFýŁś ŰćŹŰĆäŕ░Ç ŰćĺýŁäýłśŰíŁ H
2ýŁś ŰćŹŰĆäŰŐö ýáüýľ┤ýžÇŰę░, Ű░śŰîÇýŁś ŕ▓ŻýÜ░ýŚÉŰĆä Űžłý░Čŕ░ÇýžÇýŁ┤ŰőĄ. ŰőĘ, HFýÖÇ H
2ýŁś ŰćŹŰĆäýŁś ŰőĘýťäýŚÉŰŐö ý░ĘýŁ┤ŕ░Ç ý׳ýžÇŰžî Ű╣äŰíÇ ŕ┤Çŕ│äŰŐö ýŁ╝ýáĽÝĽśŰőĄ.
6. ŕ│á ý░░
Ű│Ş ýŚ░ŕÁČýŚÉýäťŰŐö ۬ĘŰôá ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČŰą╝ ýŚ┤ÝîÉ Ý׳ÝîůýŁä ÝćÁÝĽśýŚČ ýŚ┤ÝĆşýú╝Űą╝ ýťáŰĆäÝĽśýśÇýť╝Űéś, Ű▓ĄÝŐŞýÖÇ ýŚ┤ÝĆşýú╝ŕ░Ç ŰĆÖýőťýŚÉ Ű░ťýâŁŰÉśŕ▒░Űéś Ű▓ĄÝŐŞŕ░Ç ŰĘ╝ýáÇ Ű░ťýâŁŰɜۏöŰŁ╝ŰĆä ýŚ┤ÝĆşýú╝ýÖÇ ýőťŕ░ä ý░Ęŕ░Ç ŕ▒░ýŁś ýŚćýľ┤ ýŚ┤ÝĆşýú╝ ýŁ┤ýáäýŁś Off-gas Ű░ťý⣠ŕ░ÉýžÇŰŐö ýľ┤ŰáĄýŤáŰőĄ.
ŰőĘ, ŕ░üÝśĽ Ű░░Ýä░ŰŽČýŁś ŕ▓ŻýÜ░ýŚÉŰŐö ýŚ┤ÝĆşýú╝ ýŁ┤ýáäýŚÉ ŕ░ÇýŐĄŕ░Ç ŰĘ╝ýáÇ ŰÂäýÂťŰÉśŰŐö Ýśäý׹ýŁ┤ ŕ┤Çý░░ŰɜۻÇŰíť Ű░░ýÂťŰ│Ç ýžüŕĚ╝ýŚÉ ŕ░ÇýŐĄŰą╝ ŕ░ÉýžÇÝĽá ýłś ý׳ŰŐö ýäĄŰ╣äŰą╝ ýäĄý╣śÝĽśŰę┤ ýŚ┤ÝĆşýú╝Űą╝ ýí░ળýŁ┤ŰéśŰžł ýőáýćŹÝĽśŕ▓î ŕ░ÉýžÇÝĽá ýłś ý׳ŰŐö ÝĽśŰéśýŁś Ű░ęŰ▓ĽýŁ┤ ŰÉá ŕ▓âýŁ┤ŰŁ╝ŕ│á ýâŁŕ░üŰÉťŰőĄ. ŰśÉÝĽť, Ű▓ĄÝŐŞ Ű░Ć ýŚ┤ÝĆşýú╝ Ű░ťý⣠ýőť Hydrocarbon ŕ│äýŚ┤ýŁś ŕ░ÇýŚ░ýä▒ ŕ░ÇýŐĄŕ░Ç Ű░ťýâŁŰɜۻÇŰíť ýáäŕŞ░ýáüýŁŞ ýáÉÝÖöýŤÉýŁä ýáťŕ▒░ÝĽá ýłś ý׳ŰĆäŰíŁ ýéČýÜęý▓śýŚÉŰŐö Ű░ęÝĆş ýäĄŰ╣äŕ░Ç ýÜöŕÁČŰÉťŰőĄ.
Ű│Ş ýŚ░ŕÁČýŚÉýäť ýéČýÜęŰÉť ýłśýćî ýä╝ýäťýŁś ýâüÝĽťýŁÇ 4%Űíť ýáťÝĽťŰÉśýľ┤
Table 3ýŁś 1ý░Ę ýőĄÝŚś ŕ▓░ŕ│╝ŰŐö 4% ýŁ┤ýâüýŁ╝ ŕ▓âýť╝Űíť ýÂöýŞíŰɜۻÇŰíť ýáĽÝÖĽÝĽť ŕ░ĺýť╝Űíť ÝîîýĽůÝĽśŕŞ░ŰŐö ýľ┤ŰáĄýÜ░Űéś, 4%Űą╝ ý┤łŕ│╝ÝĽśŰŐö ŰÂÇŰÂäýŁ┤ ý׳ۏöŰŁ╝ŰĆä Ű░śŰ╣äŰíÇ ŕ┤Çŕ│äŰą╝ Ű▓Śýľ┤ŰéśýžÇŰŐö ýĽŐýŁä ŕ▓âýť╝Űíť ýâŁŕ░üŰÉťŰőĄ.
Űö░ŰŁ╝ýäť, ýĽ×ýť╝ŰíťŰĆä ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ýŚ┤ÝĆşýú╝ Ű░Ć ŕ░ÇýŐĄ Ű░ťýâŁŕ│╝ ŕ┤ÇŰáĘŰÉť ýőĄÝŚśýŚ░ŕÁČŕ░Ç ýžÇýćŹýáüýť╝Űíť ýŁ┤ŰúĘýľ┤ýáŞýĽ╝ ÝĽśŰę░, Ű│┤ŰőĄ ýáĽŕÁÉÝĽť ýőĄÝŚśýŚ░ŕÁČŰíť ŰŹ░ýŁ┤Ýä░Űą╝ ýĚĘŰôŁÝĽśŕ│á ŰÂäýäŁÝĽśýŚČ ýáüÝĽęÝĽť ýĽłýáäŰîÇý▒ůýŁä ýáťýőťÝĽśýŚČýĽ╝ ÝĽá ŕ▓âýŁ┤ŰőĄ. ýĽäýÜŞŰčČ, ýőĄÝŚś ŕ▓░ŕ│╝Űíť ÝÖĽýŁŞŰÉť ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ŕ░ÇýŐĄ Ű░ťý⣠ÝŐ╣ýä▒ýŁÇ ÝÖöý×Č ýí░ŕŞ░ ŕ░ÉýžÇ Ű░Ć ý┤łŕŞ░ ŰîÇýŁĹ Űô▒ýŚÉ ÝÖťýÜęÝĽá ýłś ý׳ýŁä ŕ▓âýť╝Űíť ýâŁŕ░üŰÉťŰőĄ.
7. ŕ▓░ Űíá
ŰŽČÝŐČýŁ┤ýśĘŰ░░Ýä░ŰŽČýŁś ýŚ┤ÝĆşýú╝ ýőĄÝŚśýŁä ÝćÁÝĽśýŚČ ýůÇýŚÉýäť Ű░ťýâŁŰÉśŰŐö ŕ░ÇýŐĄýŁś ÝŐ╣ýä▒ýŚÉ ŰîÇÝĽśýŚČ ŰÂäýäŁÝĽśýśÇŰőĄ. ŕĚŞ ŕ▓░ŕ│╝, Ű│Ş ýŚ░ŕÁČýŁś ýőĄÝŚś ýí░ŕ▒┤ýŚÉýäť ýĽäŰלýÖÇ ŕ░ÖýŁÇ ÝŐ╣ýä▒ýŁä ŰéśÝâÇŰâłŰőĄ.
1) ýľĹŕĚ╣ý×ČýŁś ýóůŰąśýÖÇŰŐö ŕ┤Çŕ│äýŚćýŁ┤, ýÖŞŕ┤Ç ÝśĽÝâťýŚÉ Űö░ŰŁ╝ ÝîîýÜ░ý╣śÝśĽýŚÉýäť ýŚ┤ÝĆşýú╝ŕ░Ç ŕ░Çý׹ ŰĘ╝ýáÇ Ű░ťýâŁŰÉśŰę░, ŕ░üÝśĽŕ│╝ ýŤÉÝćÁÝśĽýŁÇ ýŚ┤ÝĆşýú╝ŕ░Ç ŰŐŽŕ▓î Ű░ťýâŁŰÉśýŚłŰőĄ. ýŚ┤ÝĆşýú╝ ýáäÝŤäýŚÉ Ű░ťýâŁŰÉśŰŐö ýśĘŰĆä Ű│ÇÝÖö ýä▒ýâüýŁÇ ۬ĘŰôá ýőĄÝŚśýŚÉýäť ýťáýéČÝĽśŕ▓î ŰéśÝâÇŰéČŰőĄ.
2) ۬ĘŰôá ýőĄÝŚśýŚÉýäť ýŁ┤ýé░ÝÖöÝâäýćîŕ░Ç ŕ░Çý׹ ŰžÄýŁ┤ Ű░ťýâŁÝĽśýśÇýť╝Űę░, ýŁ╝ýé░ÝÖöÝâäýćîŕ░Ç ŰĺĄŰą╝ ýŁ┤ýŚłŰőĄ. ýŚ┤ÝĆşýú╝ ýŁ┤ÝŤä ýŁ┤ýé░ÝÖöÝâäýćîŰŐö ýŽŁŕ░Ç, ýŁ╝ýé░ÝÖöÝâäýćîŰŐö ŕ░Éýćî ýÂöýäŞŰą╝ Ű│┤ýŁ┤ŰŐöŰŹ░ ýŁ┤ŰŐö Űé┤ŰÂÇýŚÉýäť ŰÂłýÖäýáä ýŚ░ýćî ŰÉť ýŁ╝ýé░ÝÖöÝâäýćîŕ░Ç ýŚ┤ÝĆşýú╝ ýőť ÝĽťŕ║╝Ű▓łýŚÉ ŰőĄŰčëýť╝Űíť Ű░░ýÂťŰÉśýŚłŰőĄŕ░Ç ýÖŞŰÂÇýŁś ýé░ýćîýÖÇ ýáĹÝĽśŰę░ ýÖäýáä ýŚ░ýćîŰíť ýáäÝÖśŰÉśýľ┤ ŕ░ä ŕ▓âýť╝Űíť Ű│┤ýŁŞŰőĄ.
3) ýŤÉÝćÁÝśĽýŁś ŕ▓ŻýÜ░ýŚÉŰŐö 10ŕ░ťýŁś ýůÇýŁ┤ ýőťŕ░ä ý░ĘŰą╝ ŰĹÉŕ│á ýŚ┤ÝĆşýú╝Űą╝ ýŁ╝ýť╝ý╝ť, ý▒öŰ▓ä Űé┤ŰÂÇýŁś ýŁ┤ýé░ÝÖöÝâäýćîýÖÇ ýŁ╝ýé░ÝÖöÝâäýćî ŰćŹŰĆäŰŐö ýžÇýćŹýáüýť╝Űíť ýŽŁŕ░ÇÝĽśŰŐö ýÂöýäŞŰą╝ Ű│┤ýśÇŰőĄ.
4) ýľĹŕĚ╣ý×ČŰą╝ ŕŞ░ýĄÇýť╝Űíť HFŕ░Ç ŰžÄýŁ┤ Ű░ťýâŁŰÉśŰŐö ýłťýäťŰŐö LFP > NCA > NCMýŁ┤Űę░, H2ŰŐö ýŁ┤ýÖÇ Ű░śŰîÇýŁś ýłťýäťŰíť ŰžÄýŁ┤ Ű░ťý⣠ŰÉśýŚłŰőĄ.
5) HFýÖÇ H2 ŰćŹŰĆäŰŐö Ű░śŰ╣äŰíÇ ŕ┤Çŕ│äŰíť ŰéśÝâÇŰéČýť╝Űę░, ýŁ┤ŰŐö ýžÇýćŹýáüýť╝Űíť ÝÖĽýŁŞÝĽ┤Űéśŕ░ÇýĽ╝ ÝĽá ŰÂÇŰÂäýŁ┤ŰőĄ.
ÝŤä ŕŞ░
Ű│Ş ýŚ░ŕÁČŰŐö ýćîŰ░ęý▓ş ESSŃćŹýłśýćîýőťýäĄÝÖöý×Č ýĽłýáäŕŞ░ýłá ýŚ░ŕÁČŕ░ťŰ░ťýéČýŚů(ÔÇťŕ│╝ýáťŰ▓łÝśŞ-20011568ÔÇŁ)ýŁś ýŚ░ŕÁČŰ╣ä ýžÇýŤÉýť╝Űíť ýłśÝľëŰÉśýŚłýť╝Űę░, ŕ┤Çŕ│ä ýáťýťäŕ╗ś ŕ░ÉýéČŰôťŰŽŻŰőłŰőĄ.
References
1. H. C Lee, ÔÇťÔÇťUnderstanding and Evaluating the Performance and Safety of Lithium-Ion BatteriesÔÇŁÔÇŁ, The Institute of Electronics and Information Engineers, Vol. 34, pp. 20-29 (2007).
2. Q Wang, B Mao, S. I Stoliarov and J Sun, ÔÇťÔÇťA review of lithium ion battery failure mechanisms and fire prevention strategiesÔÇŁÔÇŁ, Progress in Energy and Combustion Science, Vol. 73, pp. 95-131 (2019), https://doi.org/10.1016/j.pecs. 2019.03.002.

3. H Kim, ÔÇťÔÇťMaterial Technologies for Large-scale Lithium-ion BatteryÔÇŁÔÇŁ, Korea Battery Industry Association, Dasom, pp. 239-268 (2013).
4. X Feng, M Fang, X He, M Ouyang, L Lu, H Wang and M Zhang, ÔÇťÔÇťThermal runaway features of large format prismatic lithium ion battery using extended volume accelerating rate calorimetryÔÇŁÔÇŁ, J. Power Sources, Vol. 255, pp. 294-301 (2014), https://doi.org/10.1016/j.jpowsour.2014.01.005.

5. Q Wang, P Ping, X Zhao, G Chu, J Sun and C Chen, ÔÇťÔÇťThermal runaway caused fire and explosion of lithium ion batteryÔÇŁÔÇŁ, J. Power Sources, Vol. 208, pp. 210-224 (2012), https://doi.org/10.1016/j.jpowsour.2012.02.038.

6. X Feng, M Ouyang, X Liu, L Lu, Y Xia and X He, ÔÇťÔÇťThermal runaway mechanism of lithium ion battery for electric vehicles:A reviewÔÇŁÔÇŁ, Energy Storage Materials, Vol. 10, pp. 246-267 (2018), https://doi.org/10.1016/j.ensm.2017. 05.013.

7. J Kalhoff, G. G Eshetu, D Bresser and S Passerini, ÔÇťÔÇťSafer electrolytes for lithium-ion batteries:state of the art and perspectivesÔÇŁÔÇŁ, ChemSusChem, Vol. 8, pp. 2154-2175 (2015), https://doi.org/10.1002/cssc.201500284|.


8. J Jiang and J. R Dahn, ÔÇťÔÇťARC studies of the thermal stability of three different cathode materials:LiCoO2;Li[Ni0.1 Co0.8Mn0.1]O2;and LiFePO4, in LiPF6 and LiBoB EC/ DEC electrolytesÔÇŁÔÇŁ, Electrochemistry Communications, Vol. 6, No. 1, pp. 39-43 (2004), https://doi.org/10.1016/j.elecom.2003.10.011.
9. F Xu, H He, Y Liu, C Dun, Y Ren, Q Liu, M Wang and J Xie, ÔÇťÔÇťFailure investigation of LiFePO
4 cells under overcharge conditionsÔÇŁÔÇŁ, ECS Trans., Vol. 41, No. 39, pp. 1-12 (2012).

10. M Ouyang, D Ren, L Lu, J Li, X Feng, X Han and G Liu, ÔÇťÔÇťOvercharge-induced capacity fading analysis for large format lithium-ion batteries with Li
yNi1/3Co1/3Mn1/3O
2 +Li
yMn
2O
4 composite cathodeÔÇŁÔÇŁ, J. Power Sources, Vol. 279, pp. 626-635 (2015), https://doi.org/10.1016/j.jpowsour.2015. 01.051.

11. A Du Pasquier, F Disma, T Bowmer, A Gozdz, G Amatucci and J. M Tarascon, ÔÇťÔÇťDifferential scanning calorimetry study of the reactivity of carbon anodes in plastic li-ion batteriesÔÇŁÔÇŁ, J Electrochem Soc, Vol. 145, pp. 472-477 (1998).




















