가속 율 열량계에서 충전율에 따른 리튬이온 배터리의 화재특성
Fire Characteristics of Lithium-ion Battery According to the State of Charge in an Accelerating Rate Calorimeter
Article information
Abstract
최근 기후변화와 해수면 상승 등을 유발하는 화석연료의 대체에너지로서 친환경에너지에 대한 관심이 높아지고 있다. 신재생에너지와 같은 친환경에너지의 효율적인 이용을 위해 에너지저장시스템과 스마트 그리드 시스템을 적용하는 등 많은 노력을 기울이고 있다. 하지만 이차 배터리의 사용량이 늘면서 발생하는 많은 화재 등 안전사고는 그 사용범위를 크게 제한하고 있는 상황이다. 본 연구에서는 배터리의 온도별로 발생하는 자발적 발열반응과 열폭주 현상의 특징 등을 가속 율 열량계를 이용하여 배터리 화재특성을 조사하였다. 실험에 사용된 배터리는 18650 원통형 표준 배터리로서 2600 mAh의 용량과 0, 50, 100%의 3가지 충전율로 실험을 수행하였다. 실험의 조건별로 발생하는 발열형태를 4단계로 구분하여 충전율에 따른 단계별 존재유무와 온도상승 특성을 조사하였다. 50%와 100% SOC에서 열폭주가 발생하였지만 50%의 경우 폭발 같은 격렬한 반응으로 이어지지 않았고, 100% 충전율에서 격렬한 폭발이 발생하였다. 또한, 열폭주가 발생한 50%와 100% 충전율 실험에서의 열폭주에 대한 활성화 에너지를 구할 수 있는 방법론을 제안하였다.
Trans Abstract
Recently, the interest in ecofriendly energy as an alternative to fossil fuels, which cause climate change and sea level rise, has increased. To achieve the efficient utilization of ecofriendly energy, such as a renewable energy, considerable effort has been made to use energy storage systems (ESSs) and smart grid systems. However, many safety problems, such as battery fires caused by the increase in the use of secondary batteries, significantly limit their application scope. In this study, to investigate the fire characteristics of lithium ion batteries (LIBs), the characteristics of the spontaneous exothermic reaction and thermal runaway phenomenon that occur at each temperature of an LIB battery were investigated using an accelerating rate calorimeter. The batteries used in the experiments were standard 18650 cylindrical batteries with a capacity of 2600 mAh, and they were tested at three different state-of-charge (SOC) levels: 0%, 50%, and 100%. The type of heat generated by each experimental condition was classified into four stages, and the existence and temperature rise characteristics of each stage were investigated according to the SOC. Although thermal runaway occurred at both 50% and 100% SOC, the reaction at 50% SOC did not escalate into violent explosions like the reaction observed at 100% charging. Furthermore, the activation energies for the thermal runaway observed in the experiments conducted at 50% and 100% SOC are presented.
1. 서 론
산업혁명 이후 화석연료를 통해 에너지를 생산하며 급격히 증가한 이산화탄소 발생량으로 인해 기후변화가 예견되었고, 현재 그로 인한 대기온도 및 해수면의 상승 등 이상현상의 가속화를 막기 위해 화석연료 사용량의 감소와 친환경에너지의 사용에 관한 관심이 높아지고 있다. 친환경 에너지의 수급 방법은 다양하지만, 일반적으로 에너지 생산이 연속적이지 못하며 그 장소가 제한되어있다. 따라서 에너지를 저장하기 위해 이차전지를 이용한 에너지저장시스템(energy storage system, ESS)를 사용하고 효율적인 에너지 이용을 위해 스마트 그리드 시스템을 적용하여, 화석연료 사용을 줄이는 노력이 활발하게 이루어지고 있다. ESS의 핵심요소로서 리튬이온 배터리는 에너지 밀도가 높고, 소형화가 가능하며, 기억 효과가 없는 장점이 있다. 하지만 리튬이온 배터리의 사용처와 사용량이 증가하면서 배터리 화재 사고가 빈번히 발생하고 있다(1). 리튬이온 배터리 화재는 일반적인 화재와 달리 ‘열폭주’ 현상이 발생하며 발열량이 급격하게 증가하기 때문에 반드시 개별적인 연구가 필요하다.
배터리 화재나 폭발 문제를 해결하기 위해 다양한 연구가 수행되고 있다. 기초적인 물질의 이온화로 인한 연소반응(2) 변화에 관한 연구가 수행되었고, 화재의 가장 중요한 물성치로 여겨지는 발열량을 측정하기 위해 산소소모를 이용한 발열량 측정에 관한 연구(3-5)가 활발히 진행되었다. 또한, 배터리 각 소재들의 물성과 혼합비율에 따른 변화를 관찰하는 연구(6-11), 생성 가스(12), 활성화 에너지(13), 배터리의 안정성을 평가하고 연소 특징(14)에 관한 연구 등 다양한 연구가 진행되고 있다. 소재의 온도별 반응을 확인하는데는 시차주사 열량계(differential scanning calorimetry, DSC) 또는 가속 율 열량계(accelerating rate calorimeter, ARC)가 주로 사용된다. DSC의 시료는 밀리그램 단위로 매우 작은 양의 시료를 사용하여 실험하기 때문에 양극재, 음극재, 전해질 등 각 소재의 물성을 파악할 때 일반적으로 사용한다. ARC는 상대적으로 큰 시료의 실험이 가능하고 단열조건에서의 배터리의 온도별 반응을 파악하는데 적합한 실험이다. 또한, 감지 온도의 범위가 매우 작고 설정한 스탭 온도에 따라 반응의 세밀한 파악이 가능하다. 이러한 특징을 바탕으로 특정 온도로 가열 후 시료의 변화를 관찰하기도 한다(15). 하지만, 설정한 스탭의 온도 크기가 작아질수록 실험시간이 길어지고 완전한 단열이 불가능해지므로 스탭 온도의 적절한 설정이 필요하다. 이러한 특징으로 최근 많은 가속 율 열량계 실험이 이루어지고 있고 EV-ARC를 개별로 제작하여 용량이 큰 배터리의 실험에도 사용하고 있다(16,17). 배터리는 양극재에 따라 화재의 특성이 크게 달라지는 특징이 있는데 양극재의 종류에 따라 Li,Co,O2 (LCO), Ni,Co,Al,O2 (NCA), Li,Ni,Co,Mn,O2 (NCM), Li,Mn,O2 (LMO), Li,Fe,PO4 (LFP)을 구분하고 그 소재의 세부비율에 따라 화재 안정성과 용량이 변하는 특징이 있어서 다양한 연구가 필요하다.
배터리에 관한 많은 연구가 수행되고 열폭주의 위험성을 강조하고 있지만, 배터리 화재는 외함의 형태와 소재에 따라 화재특성이 매우 크게 변하기 때문에 배터리 열폭주의 진행과정을 설명하거나 규명하는 연구는 여전히 부족하다. 휴대용에서부터 전기자동차까지 널리 사용되는 18650 배터리의 충전율에 따른 열폭주 현상의 특징과 발열반응의 발생 온도와 그 크기와 같은 화재특성을 이해하는 것이 요구된다. 따라서 본 연구에서는 열폭주 현상과 같은 배터리의 온도별 반응을 확인하기 위해 0, 50, 100% SOC 등 3 가지 충전율의 리튬이온 배터리를 가속 율 열량계에서 실험하였다. 충전율에 따른 폭발성과 열폭주 온도를 확인하였으며, 각 배터리 온도에서 온도상승률을 측정하여 배터리의 연소반응 특성을 알아보았다. 또한, 여러 방면으로 시도되고 있는 배터리 화재의 모사를 위한 기초자료를 확보하기 위해 반응차수를 1차로 가정하여 state of charge (SOC)에 따른 배터리의 활성화에너지를 예측하고 비교하였다.
2. 실험방법 및 조건
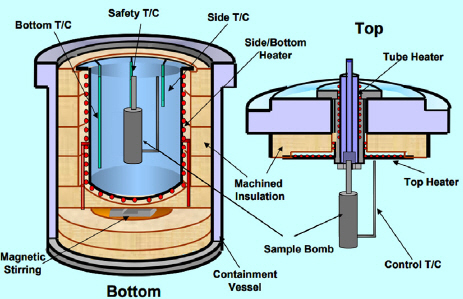
리튬이온 배터리의 화재 현상 중 열폭주 현상의 특징을 파악하기 위해 가속 율 열량계를 사용하였다. ARC 실험은 각 온도에서의 발열반응을 확인하여 열폭주가 발생하는 온도와 각 온도에서의 발열의 여부 및 크기를 확인하는데 적합한 실험으로서 장치 개략도를 Figure 1에 나타내었다. 가속 율 열량계에서 온도를 증가시키는 방법은 여러 가지가 있지만 heating-wait-search (HWS) 방식이 가장 기본적이다. HWS는 가열-대기-탐지로 각 단계의 온도에서 발생하는 발열을 탐지하여 해당 온도에서의 반응을 확인하는 실험으로서 각 온도에서 시료의 발열 여부를 확인 후 발열이 없으면 다음 단계의 온도로 진행하여 발열 여부 확인을 반복한다. 본 연구의 ARC 실험은 주어진 온도에서 HWS 단계 당 대기시간을 30 min으로 설정하였다. 따라서 반응여부를 결정하는 상승 온도의 스케일을 작게하면 총실험시간이 매우 증가하고, 반대로 상승온도 스케일을 크게 하면 열폭주 발생 시점을 판단하는데 있어 정확성이 떨어지게 된다. 따라서 본 연구에서는 정확성을 확보하면서 적절한 실험시간을 확보하기 위해 온도의 크기를 5 ℃로 설정하였다. 배터리 셀 측면에 열전대를 부착하여 온도변화를 확인하였다. 본 실험은 단열상태로 가정할 수 있으며, 온도상승을 위한 스케일이 약 5 ℃이며 서서히 가열되는 특징이 있기 때문에 시료 전체의 온도는 일정하다고 가정할 수 있다. 발열 감지 감도는 0.05 ℃/min으로 실험 범위는 상온에서 300 ℃까지 실험을 수행하였다.
배터리의 형태는 18650 배터리를 사용하였으며, 실험에 사용된 배터리의 양극재는 nickel-cobalt-manganese (NCM)으로 삼성SDI에서 생산된 삼원계 배터리를 사용하였다. 배터리 열폭주 현상은 과충전 등 여러 가지 원인으로 발생할 수 있는데, 실제적으로는 고온 분위기에서 발생한다고 하는 것이 가장 일반적인 화재원인 또는 조건으로 생각할 수 있다. 따라서 본 연구에서도 과충전에 의한 자발적인 열폭주를 연구하기 보다는 ARC를 통해 강제적으로 주위환경의 온도를 변화시켜 고온환경에 따른 정상적인 배터리의 열폭주 및 화재폭발을 연구하였다. 이 때 정상적으로 작동하는 배터리의 조건은 여러 가지가 있지만 화재에 큰 영향을 미치는 배터리 인자가 충전율이었고, 따라서 이 배터리의 충전환경을 완전충전, 종지전압에서의 완전방전 그리고 그 사이의 평균적인 충전상태를 고려하여 ARC 실험을 수행하였습니다. 실험에 사용된 배터리의 조건은 Table 1과 같이 용량은 2600 mAh이며, SOC는 0%, 50%, 100%이다. 실험에 사용한 배터리는 만충전압이 약 4.2 V이며, 50%의 경우 약 3.7 V를 나타내며 0%는 battery management system (BMS)를 통해 제어되는 종지 전압은 3.0 V이다. 시료로 사용된 배터리의 평균 중량은 46 g이다. Figure 2에 ARC 실험 전 배터리와 폭발의 유무에 따른 실험 후 배터리 형상 사진을 나타내었다.
3. 연구결과
3.1 배터리 화재의 발열과 반응
많은 기존 ARC의 연구에서는 일반적으로 열폭주가 발생하는 온도에 중점을 두고 배터리의 일반적인 온도별 반응 특성은 고찰하지 않았다. 하지만 본 연구에서는 온도 및 온도 상승률 결과를 보다 명확히 구분하고 물리적인 의미를 제공하기 위해 기존 배터리 화재연구 결과와 본 실험의 특징적인 온도상승률을 이용하여 배터리 화재를 크게 4단계로 구분하였다. Stage 1 에서는 가열되면서 solid electrolyte interphase (SEI) 의 손상이 시작되어 양극재의 리튬금속 이온들이 전해질과 반응하는 단계이다(18). SEI의 손상으로 발생하는 열량은 적지만 넓은 온도 범위에 걸쳐서 발생한다(19). SEI의 손상이 발생할 경우, SEI를 재생성하기 위해 리튬이 석출(18)되고 그로 인해 배터리 용량이 감소하는 현상이 발생한다. 이것은 배터리의 state of health (SOH)를 낮추는 역할을 하게 되기도 한다. SEI가 손상되는 과정에서 소량의 열이 발생 되지만 본 실험에서는 확인되지 않았다. Stage 2부터 가스방출과 함께 내부의 분리막이 용융 되면서 흡열반응(20)으로 온도가 낮아진 가스가 방출되고 가스방출 직후 분리막의 용융으로 인해 작은 단락(21)이 발생하여 발열반응이 진행된다. 이후 먼저 양극재와 전해질(22)이 반응하기 시작하면서 발열반응이 나타난다. Stage 3에서는 분리막이 완전히 파괴되고(22), 전해질의 기화가 발생한다(23). Stage 4 에서는 기화된 전해질과 내부에서 발생한 산소(14)가 반응하며 SOC에 따라 부분 예혼합화염 등으로 전파하며 폭발 등이 발생하게 된다. 따라서, Stage 4의 발열 곡선을 통해 산소 발생의 온도와 그 양을 추정할 수 있다(24). 발열량 측정의 산소 소모법을 이용한 발열량의 측정이 가장 적절한 방법이지만 자체적으로 발생한 산소의 양은 고려하지 못하는 특징이 있고, 산소 소모법은 배터리 자체의 가열과 주변 배터리로의 열에너지 전파를 평가하기는 적절하지 않은 방법이기 때문에 배터리 화재의 특징이나 위험성을 기술하기 위해선 가속 율 열량계 실험이 반드시 동반되어야 함을 알 수 있다.
3.2 ARC 실험 결과
Figure 3에 SOC 0%의 시간에 따른 온도 변화 및 온도상승률을 도시하였다. SOC 0%는 Stage 1에서의 SEI가 붕괴하는 단계는 같게 발생한다. 이후 가스방출이 발생하였는데, 분리막의 손상과 함께 흡열반응으로 상대적으로 낮은 온도의 가스가 분출되면서 온도가 낮아진 것을 확인할 수 있다. 이후 큰 발열반응 없이 HWS 가 진행되어 200 ℃에서 약간의 발열이 관찰되었는데, 내부의 단락으로 인해 발생한 발열로 보인다. 일반적으로 배터리의 많은 발열 원인 중 가장 큰 발열량을 가지고 있는 내부의 완전한 단락(22)이다. 배터리의 충전량은 0%이지만, 3.0 V 정도의 전압을 가지고 있으므로 내부에서 단락이 발생하고 그로 인한 발열이 발생한 것으로 보인다. 이후 추가적인 발열반응은 나타나지 않았다.
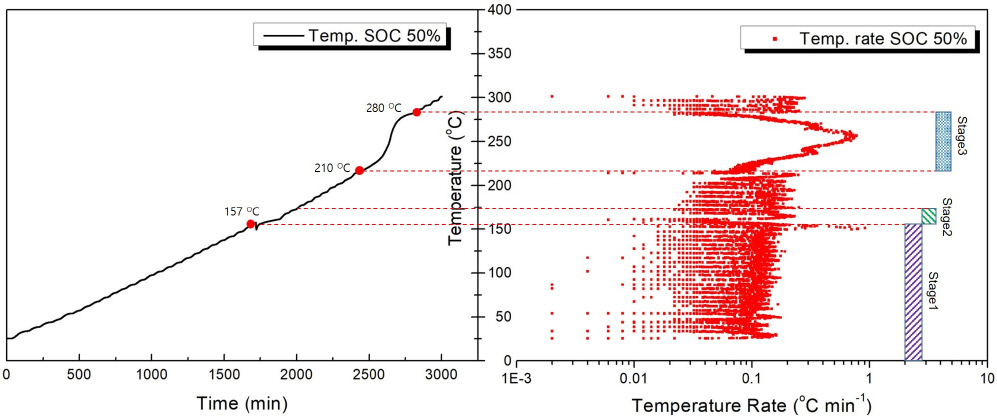
Figure 4는 SOC 50%의 실험결과이다. Stage 1은 SOC 0%와 같은 형태로 발생하였으며 가스방출 발생 온도 역시 157 ℃로 SOC 0%와 큰 차이가 없었다. 하지만 Stage 2에서 나타나는 가스방출 이후 발열반응을 확인할 수 있었다. 발열량이 많지 않아 큰 온도상승을 확인하지 못하였고 다음 발열반응이 발생하는 온도에 도달하지 못하여 HWS가 진행되었다. 이후 205 ℃에서 Stage 3가 발생하였으나 그 크기가 크지 않았고, 이러한 특성은 온도상승률의 변화에 대한 그래프에서 확인할 수 있다. 이후 열폭주가 발생하여 Stage 4의 반응들을 확인할 수 있었으나 SOC가 낮은 이유로 큰 발열량을 보이지 못하고 여러 단계의 발열반응이 나타난 것을 확인할 수 있다. 280 ℃에서 열폭주가 종료되어 다시 HWS가 진행되어 300 ℃에 도달하였다.
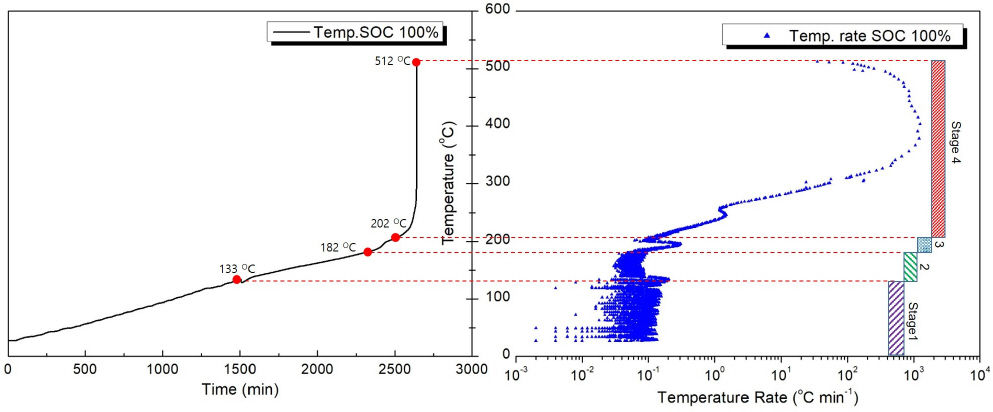
Figure 5에는 SOC 100% 배터리의 ARC 실험결과를 도시하였다. 작은 SOC 경우와 달리 낮은 온도인 133 ℃에서 가스방출이 발생하였으며 발생 직후 자체적인 발열반응으로 열폭주까지 도달하였다. 182 ℃와 202 ℃에서 온도상승률이 크게 변하였고 반응이 진행되었다. 이 과정에서 시료의 외함이 폭발하여 큰 질량감소를 확인할 수 있었는데, 외함이 파괴되면서 전해질과 같은 물질들이 열원과 분리되면서 충분한 발열량을 내지 못하였을 것으로 보인다. SOC 100%의 Stage 4는 배터리의 열폭주 과정에서도 온도상승률이 단계별로 변하는 것을 확인할 수 있는데 이것은 열폭주 과정에서 내부 물질의 반응하는 단계로 보이며 배터리의 구성물질의 특징으로 인해 발생한 것으로 보인다. 이러한 단계는 SOC 50%의 경우에서도 동일하게 관찰할 수 있는데, 충전량에 따라 그 크기가 변하는 것을 확인할 수 있다.
위 실험을 통해 나타난 그래프들은 ARC 실험을 통해 나타날 수 있는 배터리 반응의 대표적인 예시로 볼 수 있다. Case 1은 열폭주가 발생하지 않은 경우이며, Case 2는 발열이 발생하였지만, 곧바로 열폭주로 이어지지 않은 경우이다. Case 3은 대표적인 열폭주 반응을 통해 폭발과 함께 큰 발열량을 나타내는 경우로 볼 수 있다. 실험에서 얻은 여러 결과 값들을 Table 2에 나타내었다. 여기서 TONSET은 발열반응이 시작되는 온도이며 본 실험에서는 배터리 자체에서 가스 방출이 발생한 온도와 같다. 또한, TTR과 (dT/dt)max는 각각 열폭주가 발생한 온도와 단위 시간당 온도변화의 최댓값을 의미하고, 최종적으로 배터리 폭발(explosion) 유무를 Table 2에 나타내었다. SOC 50%까지는 가스방출이 발생하는 온도인 TONSET의 온도가 크게 바뀌지 않는 모습과 폭발이 일어나지 않고 배터리 외함의 가스방출이 발생한 곳을 통해 내부의 물질들이 모두 기화되어 같은 질량감소가 나타난 것으로 보인다. Case 3은 폭발과 함께 큰 질량감소가 발생하였다.
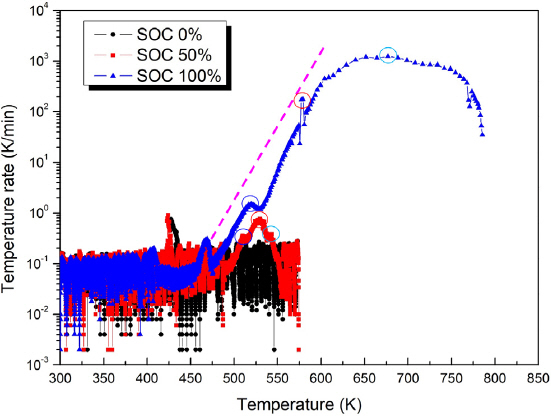
Figure 6은 온도상승률의 실험결과를 비교한 그래프이다. SOC 50%와 100%의 온도 상승하는 횟수와 형태 등이 유사한 특징이 나타나는 것을 확인할 수 있다. 이것은 반응 물질과 단계는 유사하지만, 그 발열량의 크기와 반응물의 생성량의 차이가 나는 것을 확인할 수 있는 결과이다.
Figure 7에 나타난 자발적 온도상승의 기울기는 1차 반응을 고려하면 활성화에너지와 충돌빈도인자를 간단하게 유추하는데 사용할 수 있다. 즉, 리튬이온 배터리의 열폭주 단계에서 온도상승은 단열조건에서의 자기발열에 의한 온도변화, ΔTad 를 의미하고, 온도상승에 걸리는 시간은 배터리의 화학반응시간(chemical time), tchem 으로서 사용할 수 있다. 화학반응시간은 반응 상수(rate constant)의 역수로 표현할 수 있으므로 식(1)과 같이 온도상승에 대한 식을 얻을 수 있다. 여기서 A 는 빈도 인자(frequancy factor), Ea 는 활성화 에너지, kb 는 볼츠만상수이다.
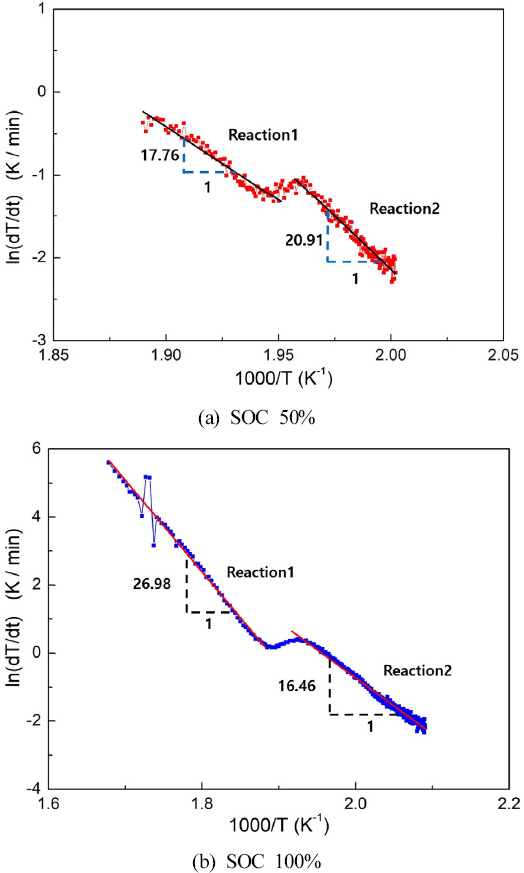
Plots of ln (dT/dt) versus 1000/T at (a) SOC 50%, (b) SOC 100% ; liner line were used to estimate the value of Ea and A for each self-heating region.
배터리의 화학반응에 대한 중요 파라미터를 결정하기 위해서 식(1)의 양변에 자연로그를 취하여 얻은 식(2)에서 절대온도에 대한 역수의 기울기로서 활성화에너지를 얻을 수 있다.
식(2)와 같은 방법으로 중요 반응 파라미터를 얻기 위해 배터리의 열폭주 단계의 로그 스케일 온도변화를 Figure 7에 도시하였으며, 얻어진 결과값을 Table 3에 정리하였다. Figure 7에 도시한 선형 회귀분석 결과의 기울기는 -Ea/(1000×kb) 을 의미하여 활성화에너지 값을 구하는데 이용할 수 있다. 두 SOC에서 모두 온도구간에 따라 확연히 다른 두 개의 반응 기울기가 관찰되며, 반응의 기울기가 변화함에 따라 Reaction 1과 Reaction 2로 구분하여 나타내었다. 선형변화를 가정하여 최소자승법(least squre method)으로 분석하였을 때 SOC 50%의 Reaction 1과 Reaction 2의 R2 값은 각각 0.94, 0.91이며, SOC 100%의 Reaction 1과 Reaction 2의 R2 값은 각각 0.98, 0.99로 높은 R2 결과를 나타내어 충분히 신뢰할 수 있는 결과를 얻을 수 있었다. Figure 7(a)에서와 같이 50% SOC 배터리의 경우 낮은 온도의 열폭주 초기 구간에서는 온도상승 기울기 값이 20.9 K으로 빠른 반응속도를 나타내지만, 온도가 상승한 Reaction 1 구간에서 17.8 K으로 다소 낮아진 값을 보인다. 또한, Figure 6(b)의 SOC 100% 실험결과에서는 활성화 에너지를 의미하는 온도상승률의 기울기가 낮은 온도의 초기 구간에서는 16.46 K로 50% SOC 배터리에 비해 낮게 측정되었고, 높은 온도인 Reaction 1 구간에서는 26.98 K으로 매우 큰 값을 보였다. 온도에 따른 반응단계인 Reaction 1과 Reaction 2의 온도변화률의 경향성이 SOC에 따라 다르게 나타나는 이유는 주어진 온도에서 배터리에서 배출되는 여러 물질의 성분과 조성이 다르기 때문으로 판단된다. 배터리 온도에 따른 배출가스를 조사한 기존연구(25)에서 보면 SOC에 따라 다양한 탄화수소 가스의 조성이 크게 차이 날 뿐 아니라 반응에 중요한 산화제인 산소의 생성 또한 SOC가 커질수록 높은 농도를 나타내었다. 따라서 배터리의 SOC가 커질수록 열폭주 과정에서 높은 온도의 반응구간인 Reaction 1에서 반응 온도 또한 높아 매우 빠른 반응속도를 보이며 폭발에 이른다고 할 수 있다. Table 3에는 얻어진 실험결과에 대해서 실제 반응 파라미터인 활성화에너지와 온도상승으로 변형된 빈도인자를 최종 제시하였지만, 이 값들은 반응차수를 알 수 없는 등의 불확실성이 크기 때문에 자세한 화학반응식을 통한 수치해석의 기초 자료로서 정성적 평가에 활용할 수 있을 것으로 판단된다(13).
4. 결 론
본 연구에서는 열폭주 현상과 같은 배터리의 온도별 반응을 확인하기 위해 0, 50, 100% SOC 등 3 가지 충전율의 리튬이온배터리를 가속 율 열량계에서 실험하였다. 충전율에 따른 폭발성과 열폭주 온도를 확인하였으며, 각 배터리 온도에서 온도상승률을 측정하여 배터리의 연소반응 특성을 알아보았다. 연구에서 얻어진 결과는 다음과 같이 요약할 수 있다.
1. 충전량에 따라 열폭주의 여부가 결정되었으며, SOC의 증가에 따라 열폭주를 하지 않는 경우, 열폭주가 발생하였으나 폭발하지 않은 경우, 열폭주가 발생하여 폭발한 경우 등 크게 3 가지의 현상학적 온도상승 그래프를 확인할 수 있었다.
2. 본 연구에서는 가속 율 열량계실험의 온도 및 온도 상승률 결과를 통해 각 온도에서의 나타나는 특징적인 발열 여부를 확인하여 배터리 화재를 크게 4단계로 구분하였다. 가열에 의해 가스가 발생하는 2단계에서는 0%와 50% SOC에서는 가스방출이 발생하는 온도가 유사하지만, 100% SOC에서는 가스 방출온도가 낮아졌다. 열폭주가 발생하는 3단계는 50%와 100% SOC에서만 관찰되었고, 매우 높은 온도상승률을 보이는 4단계는 100% SOC에서 관찰되어 강한 폭발현상을 동반하였다.
3. 50% SOC 배터리의 경우 낮은 온도의 열폭주 초기 구간에서는 온도상승 기울기 값이 상대적으로 커서 빠른 반응속도를 나타내지만, 높은 온도 구간에서는 다소 낮아진 값을 보인다. 또한, SOC 100% 실험결과는 온도상승률의 기울기가 낮은 온도의 초기 구간에서는 50% SOC 배터리에 비해 낮게 측정되었고, 높은 온도 구간에서는 매우 큰 값을 보였다.
4. 온도에 따른 두 반응단계에서 온도변화율의 경향성이 SOC에 따라 다르게 나타나는 이유는 주어진 온도에서 배터리에서 배출되는 여러 물질의 성분과 조성이 다르기 때문으로 판단된다. 배터리 온도에 따른 배출가스를 조사한 이전 연구에서도 SOC에 따라 다양한 탄화수소 가스의 조성이 크게 차이 날 뿐 아니라 반응에 중요한 산화제인 산소의 생성 또한 SOC가 커질수록 높은 농도를 나타내었다. 따라서 배터리의 SOC가 커질수록 열폭주 과정에서 높은 온도의 반응구간에서 매우 빠른 반응속도를 보이며 폭발에 이른다고 할 수 있다. 이러한 연구결과는 온도상승률의 기울기를 통한 활성화 에너지를 유추할 수 있게 하여 화학반응기구를 통한 배터리 화재 수치해석연구에 적용할 수 있을 것으로 기대된다.