리튬이온 배터리 화재의 충전율 효과에 대한 모사연료 모델링
Surrogate Model for the Effect of Charge State in Lithium-ion Battery Fires
Article information
Abstract
요 약
최근 발생하는 이상기후와 환경 문제로 친환경 에너지 수요가 급증하고 있으며 효율적인 에너지 사용을 위해 배터리 사용량이 급격하게 증가하였다. 하지만 배터리 화재 사고 또한 증가하고 있어 보다 안전한 사용과 화재특성을 밝히기 위해 많은 연구가 진행되고 있었다. 배터리의 많은 종류로 인해 모든 경우의 실험을 수행하기 어렵기 때문에 배터리 화재를 모사하기 위해 다양한 방법이 시도되고 있다. 이 연구는 배터리 열폭주 현상의 모델링 방법을 제시하기 위해 충전율의 효과와 배터리 가연물을 모사하는 방식을 제시하였다. 배터리의 구성물질을 기반으로 모사연료 3가지를 선정하였으며, 배터리 화재의 충전율이 증가할 때 일어나는 효과를 모사하기 위해 산소의 농도를 높이는 방식을 사용하였다. 그 결과 산소농도의 증가로 온도와 압력이 상승하였으며, 배터리의 열폭주로 나타나는 폭발을 적절히 모사할 수 있었다. 특히 모사연료 중 고온에서 반응하는 C2H6는 배터리의 물리적 폭발에 기여할 뿐만 아니라 H2와 CH4등으로 열분해 되어 화학적 폭발의 위험도 함께 증가하는 특성이 있음을 확인하였다.
Trans Abstract
ABSTRACT
Recently, the demand for eco-friendly energy sources, including batteries, has increased rapidly owing to growing climate and environmental problems. However, battery fire accidents are also increasing, and many researchers are focusing on the safe use of batteries and their flammability characteristics. Owing to the multiple battery types, conducting experiments is difficult in all cases, so various methods to model battery fires are being attempted. This study focuses on the effect of charge states and models surrogate fuels for battery thermal runaway. Three surrogate fuels were selected based on the battery components, and a method of increasing the oxygen concentration was adapted to model the effect that occurs when the charge states of a battery fire increases. As a result, the temperature and pressure increased in all cases, and it appears that the explosion caused by the battery thermal runaway can be simulated by the model. One of the results of this study is that ethane exposed to a high temperature not only contributes to the physical explosion of the battery but also increases the risk of chemical explosion as it decomposes in to H2 and CH4.
1. 서 론
최근 발생하는 지구온난화 등 이상기후의 주된 원인으로 알려진 화석연료를 대체하기 위해 많은 연구와 노력이 이루어지고 있다. 그중 하나로 배터리를 사용하여 잉여 에너지를 저장하는 등 효율적인 에너지 사용을 통해 화석연료 사용량을 줄이고자 노력하고 있다. 그 예시 중에는 energy storage system (ESS)를 사용하거나 스마트 그리드 시스템 활용 등이 있고 에너지 저장장치로 리튬이온 배터리가 사용되고 있다. 하지만 이러한 시스템에 사용되는 리튬이온 배터리는 이물질 혼입, 분리막 손상과 같은 불량 상태를 진단하기 어렵고 화재 발생 시 열폭주 반응으로 인해 큰 피해가 발생하고 있다. 배터리의 열폭주 반응의 크기나 유무는 배터리의 구성물질 종류와 충전율에 따라 크게 좌우된다. 배터리의 주요 구성물질은 양극재, 음극재, 분리막, 전해질이다. 양극재는 리튬과 함께 망간, 니켈, 코발트, 철 등이 산소와 결합하여 그 종류와 비율에 따라 안정성과 용량의 크기 등 배터리의 특성이 크게 달라진다. 음극재는 주로 흑연을 사용하여 탄소로 구성돼있는 경우가 많으며 분리막은 다공성 폴리머 소재로 주로 탄소와 수소로 구성되어 있다. 전해질은 ethylene carbonate (EC), propylene carbonate (PC)와 같은 유기용매와 dimethyl carbonate (DMC), diethyl carbonate (DEC), ethylmethyl carbonate (EMC) 같은 보조용매를 혼합하여 사용한다. 유기용매와 보조용매의 종류는 다양하지만, 구성물질은 대부분 탄소, 수소, 산소로 구성되어 있다. 이처럼 배터리 구성물질은 양극재의 금속과 함께 대부분 탄소, 수소, 산소의 혼합물로 이루어져 있다. 음극재의 흑연은 연소에 필요한 에너지가 크기 때문에 열폭주와 같은 급격한 발열에서는 열전달 시간이 충분하지 못한 이유로 많은 양이 연소 되지 못한 채로 남고, 산화 금속은 발열량에는 크게 기여하지 않고 금속의 종류에 따라 산소를 방출시키는 정도가 달라진다. 이러한 이유로 배터리 화재의 발열량은 전해질의 연소가 많은 부분을 차지한다. 충전율이 증가함에 따라 나타나는 효과로는 양극재와 음극재에서 리튬과 함께 산소가 방출되어 내부에서 발생하는 산소의 양이 증가하고 이 산소의 산화반응으로 인해 열이 발생한다(1). 또한, 음극재와 양극재의 전위차가 커지게 되고 이때 분리막이 손상될 경우 내부 단락이 발생하여 열이 발생하는데(2) 이 과정에서 큰 열이 발생하고 다른 물질들을 활성화 시키면서 열폭주가 발생하는 것으로 알려져 있다. 이러한 이유로 충전량이 증가함에 따라 내부의 산소량과 열이 증가하고 지수함수 형태로 열이 증가하는 열폭주가 발생한다. 열폭주가 발생하면 내부에서 고온과 함께 기화된 가연물로 인해 내부 압력이 높아진다. 이후 외함이나 압력방출 밸브를 파괴하면서 고온의 가연물이 제트 형태(3)로 분출되어 외부의 공기와 빠르게 혼합되어 부분예혼합화염 형태의 화재 또는 폭발로 이어진다(4).
배터리 화재에 관한 실험적 연구는 콘 칼로리미터(5), copper slug battery calorimetry (CSBC)(6), accelerating rate calorimeter (ARC)(7), 시차 주사 열량계(differential scanning calorimetry)와 오븐 노출 시험(oven exposure test)(8), 방출가스를 곧바로 포집한 뒤 FT-IR(9), GC-MS(10)와 같은 분석기에 연결하여 방출가스의 성분과 조성을 분석하는 등 다양한 방식을 통해 진행되고 있다. 하지만 배터리를 구성하는 소재와 크기는 매우 다양하다. 따라서 모든 경우의 실험을 수행하기 어렵기 때문에 수치해석을 통해 배터리 화재를 모델링 하는 연구가 수행되고 있다. 배터리 화재 모델링에 관한 연구로는 오븐 노출 실험 등이 1차원(11), 3차원(12)에서 예측모델을 사용하여 재현되었고, Esho 등(13)은 열폭주 발생 온도에 관한 모델링 연구를 수행하였다. 이 연구에 의하면 열폭주는 배터리 온도에 따른 열의 발생, 셀 내부의 열전도도, 셀 표면으로의 열 발산등으로 이루어진 열의 균형에 의해 열폭주가 발생한다. 그리고 아레니우스식의 형태를 가진 방정식 을 제시하여 열폭주 온도를 예측하였다. Anderson 등(14)은 COMSOL을 사용하여 리튬이온 배터리의 열폭주와 화재확산을 모델링 하였으며, Feng 등(15)은 열평형 방정식을 기반으로 3차원 열폭주 모델링을 수행하여 배터리 화재를 모사하였다. Ko와 Lee(16)가 배터리의 충전 시 전해질 등이 이온화된다는 점에 착안하여 반응물에 수소를 첨가하는 방법으로 충전율 효과를 단순화하여 모델링을 시도하였지만, 그 효과가 크게 나타나지는 않았다. 이 연구에서는 배터리 화재를 모사하는 방법을 제시하기 위해 CHEMKIN의 perfectly stirred reactor (PSR)(17)을 이용한 수치해석을 수행하였다. PSR은 화학종의 세부 반응기구와 에너지방정식 등을 이용하여 반응용기 내의 물질들의 반응을 해석할 수 있다. 반응과정의 형태와 입력조건을 적절히 선정해야 모델에 대한 적절한 결과를 얻을 수 있기 때문에 상황의 모델링과 입력조건 설정이 중요하다. 하지만 산업에서 사용하는 복잡한 물질들은 세부 반응식이 알려지지 않은 경우가 많다. 이러한 이유로, 배터리 소재에서 발생하는 물질로 알려진 화학종들 중 주로 발생하는 물질들을 선정하여 배터리 화재의 모사연료(surrogates)로 사용하였으며, 배터리 충전율의 효과를 모사하기 위해 산소량을 조정하였다. 배터리 내부에서 발생하는 반응을 이해하고 배터리 화재 모델링 방법으로서 이 연구 방식을 제시하고자 한다.
2. 연구방법
2.1 수치해석
이 연구에서는 이러한 배터리 내부에서 발생하는 열폭주 현상을 PSR을 통해 모사하였고, CHEMKIN-Pro에서 포함되어있는 C2_NOx 반응기구를 사용하였다. 이 반응기구는 Naik 등(18)에 의해 가솔린 등 여러 가지 물질이 혼합된 연료의 산화를 모사하기 위한 개발된 반응기구를 기반으로, 수소, 메탄, 에탄 등의 산화 반응기구를 추가하였으며 NOx의 생성은 GRI 3.0(19)을 이용하였다. C2_NOx의 기초가 된 반응기구는 혼합연료를 모사하기 위한 반응기구인 만큼 이 연구에서도 적합하게 사용할 수 있을 것으로 보이며, 이후 배터리 화재등에서 생성되는 질소산화물과 같은 화재 오염물연구에 대한 확장성을 고려하여 선택하였다. C2_NOx 반응기구는 수소, 메탄, 에탄등의 산화반응을 넓은 온도와 압력 범위에서 사용할 수 있는 것으로 알려져 있으며, 탄화수소의 산화 반응을 설명하는 99개의 화학종과 693개의 기본반응식을 포함하여 가역반응으로 구성되어 있다. 연구에 사용한 지배방정식으로는 가스 에너지방정식과 화학종 방정식이 있다. 반응에 사용된 반응용기는 정적 조건의 밀폐 균일 반응기(closed homogeneous reactor)를 사용하였다. 0-차원으로 부피와 관계없이 균일혼합되어 있으며 열 손실은 없는 것으로 가정하였다. 반응용기의 초기온도와 압력은 반응기구의 특성과 모사 상황을 고려하여 800 K, 1 atm로 설정하였다.
2.2 연료 모사
이 연구에서는 배터리 화재 가연물을 모사하기 위해 배터리에 사용되는 물질의 반응을 문헌 조사를 통해 확인하였고, 그 대표적 반응을 Table 1에 나타내었다.
하지만, 이 반응들의 존재는 실제 제조된 배터리 종류에 따라 다를 뿐 아니라 그 범위가 다양하여 가연물의 양과 조성을 신뢰하기 어려웠다. 따라서 이 연구에서는 Table 1의 반응을 참고하여 임의로 3 가지의 모사연료를 선정하였다. 먼저 전해질로 사용되는 EC와 DMC의 분해로 발생되는 C2H4와 C2H6를 1:1의 비율 혼합하여 Surrogate 1을 선정하였다. CH4와 H2가 발생한다는 연구를 참고하여 C2H4, C2H6, CH4, H2를 1:1:1:1로 섞은 경우를 Surrogate 2로 선정하였다. 배터리 화재의 연구 중 수소농도의 감지를 강조하거나, 방출가스에서 높은 수소농도(25,26)가 측정된 연구 등을 고려하여 고농도의 H2가 포함된 모사 연료의 효과를 확인하고자 하여 C2H4, C2H6, CH4, H2를 1:1:1:7로 섞은 경우를 Surrogate 3로 선정하였다. 이와 같이 최종 결정된 모사연료의 조성을 Table 2에 나타내었다.
2.3 충전율 효과모사
배터리 화재에서 충전율에 따라 나타나는 효과를 모사하기 위해 배터리의 충전율에 따라 산화된 리튬과 방출되는 산소의 양이 증가한다는 점(4,20)을 고려하여 모사연료에 산소를 추가는 방식으로 충전율의 증가를 모사하였다. 이 연구의 모델링은 점화된 상황을 모사하려 하므로 연료의 조성 중 점화온도가 가장 높은 물질인 수소의 점화온도를 고려하여 충분히 연소 가능한 온도인 800 K으로 선정하였다. 모사연료의 조성이 변함에 따라 점화가 발생하는 산소의 농도가 달라지기 때문에 점화가 일어나는 산소의 농도가 연료에 따라 다르게 나타났다. 따라서 해당 모사연료에 점화가 일어나는 산소농도를 O2,crit로 하여, 그 농도를 기준으로 더 낮은 충전량의 상황을 모사한 O2,low, 더 높은 충전량의 상황을 모사한 O2.high로 하여 생성물질과 온도, 압력과 같은 결과값의 경향성을 비교하였다. 점화의 판단기준은 온도 변화량 300 K으로 설정하였으며 O2,crit을 기준으로 전후 농도에서의 경향성을 파악하고자 선정한 O2,low, O2,high의 산소농도를 Table 3에 나타내었다. 추가로 산소의 농도를 매우 낮게 설정하여 산소와의 반응이 일어나지 않는 경우(non-reactive)를 추가하여 충전량이 높은 조건과 비교할 수 있도록 나타내었다.
3. 결과 및 고찰
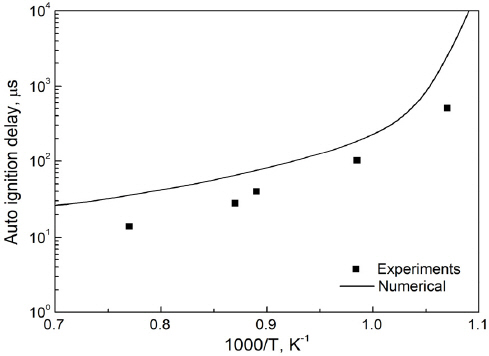
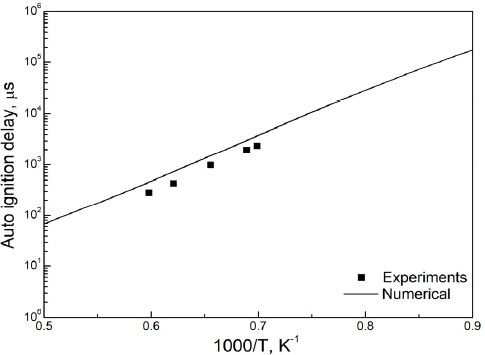
배터리 화재를 모사하기 전, 선정한 반응기구의 적합성을 확인하기 위해 C2_NOx 반응기구를 이용해 계산한 점화지연시간과 실험 데이터를 비교하였다. 모사연료에 사용된 연료 중 수소와 메탄을 대상으로 하였으며, 수소와 메탄의 점화지연시간의 실험값은 이전 실험연구(27,28)를 통해 확인하였다. Figure 1은 수소와 공기를 완전혼합 당량비로 혼합하여 상압(1 atm)의 조건에서 수소의 점화지연시간을 나타낸 것이고(27), Figure 2는 CH4, 산소, 질소를 0.0525:0.2098:0.7377의 비로 혼합한 혼합기의 약 0.81 atm에서의 점화지연시간을 나타낸 것이다(28). 자연점화과정에서 점화시간의 결정은 수소의 경우 OH 값의 피크가 나타나는 시간, CH4의 경우 CH 값의 피크가 나타나는 시간으로 설정하였다. 사용된 C2_NOx 반응기구가 자연점화온도 예측을 주된 목적으로 개발된 반응기구는 아니지만, Figures 1과 2에서 보듯이 이 두가지 연료에 대해 실험값과의 경향성을 잘 나타내는 것으로 보아 모사연료의 산화 반응을 적절히 모사할 수 있음을 검증하였다.
리튬이온 배터리 화재를 대표하는 전해액 모사연료 반응기구를 점화지연시간으로 검증하였고, 이 반응기구를 이용하여 배터리 충전율 효과를 산소농도 변화로 상사시켜 리튬이온 배터리 화재의 반응특성을 3가지 모사연료에 대해서 계산하여 그 결과를 고찰하였다.
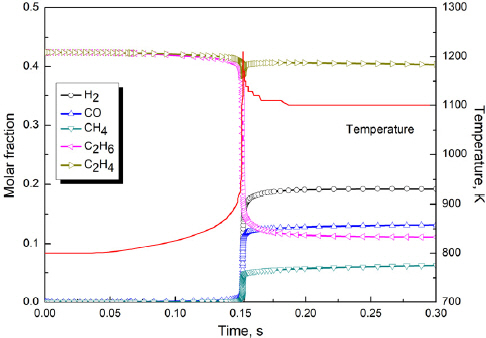
Figure 3은 수치해석을 통해 나타난 Surrogate 1의 산소농도에 따른 온도와 압력의 그래프이다. Surrogate 1은 C2H6와 C2H4를 1:1로 혼합한 모사연료이다. Surrogate 1의 자연점화가 처음 일어나는 산소농도(O2,crit)는 11%로 최대온도는 1100 K으로 나타났지만 이후 급격히 온도가 감소하여 1020 K으로 점근하였다. 또한 O2,high 조건에서는 최대온도 1230 K에서 1100 K으로 온도 감소가 크게 나타났고, 이러한 온도감소 반응은 최대온도가 높을수록 급격하게 나타났다. 이때 온도가 감소하는 구간에서 압력은 감소하지 않고 다소 증가하였는데, O2,crit 산소농도 11%에서의 최대 압력은 1.59 atm으로 나타났으며, O2,high 조건에서는 1.88 atm으로 나타났다. 이와 같은 Surrogate 1 모사연료 반응에서 온도의 급격한 감소, 압력 상승 등과 같은 특징은 C2H6가 C2H4, CH4, H2 등으로 열분해 되는 과정에서 발생하는 것으로 보인다. 이러한 결과를 뒷받침 해주는 자료로 Surrogate 1의 O2,high 조건에서 화학종들의 몰분율 변화에 대한 그래프를 Figure 4에 나타냈다.
Figure 4는 시간에 따른 화학종들의 몰분율과 온도 그래프를 나타낸 것이다. 약 0.15 s에서 점화가 발생하여 최대온도에 도달한 직후 온도감소가 발생하였다. 화학종들의 몰분율 변화는 점화가 발생하면서 C2H6의 급격한 감소가 나타났으며, CH4, H2는 증가하였다. 반응 초기에 C2H6와 C2H4가 산소와 반응하여 농도가 감소하지만 C2H4의 농도는 다시 증가하였다. CH4와 H2의 농도가 증가하여 반응용기 내의 기체 분자 수가 증가하는 것을 확인할 수 있는데 이러한 결과는 C2H6가 고온 환경일수록 크게 나타났다. 따라서 C2H6가 열분해하는 것을 확인할 수 있었으며 열분해로 인한 기체 분자 수 증가가 압력상승의 큰 요인이 되었고 이로 인해 온도감소가 발생하였음에도 압력이 상승한 것으로 보인다.
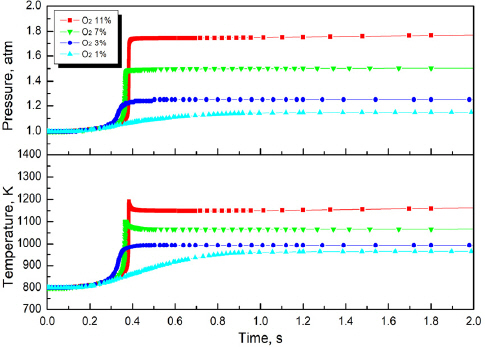
Figure 5는 Surrogate 2의 산소농도별 온도와 압력을 도시한 것이다. Surrogate 2는 배터리의 구성물질 중 Surrogate 1에서 사용한 C2H6와 C2H4와 함께 H2와 CH4를 1:1:1:1로 혼합한 모사연료이다. 점화가 발생하는 최소점화산소 농도인 O2,crit은 7%로 Surrogate 1에 비해 낮으며, 이때의 압력은 1.5 atm 으로 나타났다. 점화 지연시간은 약 0.38 s로 나타났으며 Surrogate 1과 마찬가지로 온도감소가 나타났다. 산소농도 11%인 O2,high에서의 최대온도 1197 K, 압력은 1.78 atm으로 나타났다. 이러한 값을 Surrogate 1과 비교할 경우 같은 산소농도를 기준으로는 Surrogate 2가 최대온도와 압력이 높게 나타나는 것을 확인할 수 있는데, 이러한 결과는 수소의 농도에 따라 크게 변하는 것으로 보인다. 같은 산소 농도에서 수소의 농도가 높아짐에 따라 당량비 1에 가까워지기 때문에 화염온도는 상승하는 것으로 보인다. 또한 점화지연시간이 길어지며 연소범위가 증가하는 것으로 나타났다.
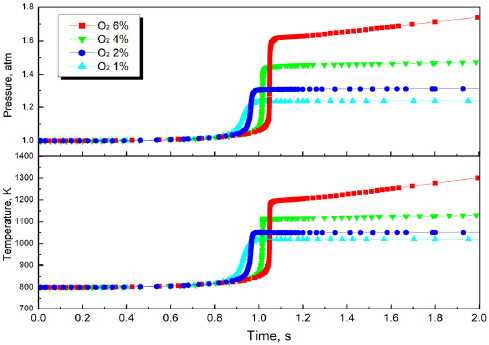
Figure 6은 Surrogate 3의 산소농도별 시간에 따른 온도와 압력을 도시한 것이다. 점화가 발생하는 최소 농도인 O2,crit은 4%로 나타나 Surrogate 3의 연소범위가 매우 넓은 것을 알 수 있으며, O2,crit에서의 점화지연시간은 약 1 s, 온도는 1100 K, 압력은 1.66 atm으로 나타났다. Surrogate 3는 O2,high 조건에서 온도가 지속해서 상승하는 결과를 나타냈다. C2H6로 인해 나타나는 특징은 최대온도 이후 온도감소를 발생시켰으며, 압력상승의 주요한 원인으로 나타났다. 반면에 H2는 모사연료의 주요한 화염 온도상승과 연소범위를 증가시켰다.
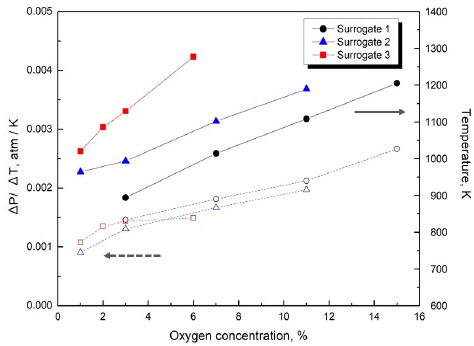
이러한 수치해석의 결과를 종합적으로 분석하였을 때 모든 연료에서 산소가 증가함에 따라 온도와 압력이 상승하였다. 모사연료의 구성물질인 CH4, H2, C2H4, C2H6 중 산소와 가장 활발하게 반응한 물질은 C2H6로 나타났다. C2H6은 높은 산소농도로 인해 발생한 고온 환경에서 CH4, H2, C2H4 등으로 분해되었으며 반응용기 내의 기체 몰수를 증가시켰고, 이것은 빠른 압력상승으로 나타났다. 각 모사연료들의 결과 중 산소농도에 따라 최고온도와 그 온도에서의 온도상승에 따른 압력변화의 크기를 Figure 7에 나타내어 비교하였다. 모든 모사연료에서 산소농도의 증가는 최대온도의 증가를 가져왔고, 이러한 특성은 혼합기가 연료과잉 상태에서의 반응이기 때문이다. 하지만 그 기울기에 있어서는 모사연료에 따라 큰 차이가 있다. Surrogate 3은 다른 모사연료에 비해 산소농도가 증가함에 따라 최대온도 변화율이 매우 큰 결과를 보이는데 이러한 특성은 수소를 주성분으로 사용한 Surrogate 3에서 산소의 증가는 이론 당량비로 만들기 때문이다. Figure 7에서는 또한 초기온도로부터 반응온도 변화에 대한 압력변동을 도시하였는데, 이 물리량은 이상기체 상태방정식으로 생각하면 전체적으로 반응에서의 최대 기체 몰 수의 변화를 의미할 수 있다. 모든 모사연료에서 산소농도가 커지면 온도변화에 따른 압력변동이 커져 생성 기체의 양이 증가함을 확인할 수 있다. 하지만 Surrogate 3에서는 산소농도가 증가함에 따라 기체 몰수는 크게 변하지 않았는데, 이 특성 또한 높은 산소 농도의 반응에서는 수소의 영향성이 크게 나타나기 때문으로 이해할 수 있다. 이상과 같은 3가지 모사연료는 온도나 압력에 대한 차이는 존재하지만 SOC에 따른 화재 및 폭발 특성을 잘 나타낸다고 할 수 있다. 이러한 모사연료의 반응특성은 C2H6와 H2의 농도에 따라 결정되어 각각 배터리 화재에서 압력증가로 인한 물리적 폭발 요인과 연소범위 확대로 인한 화학적 폭발의 요인으로 나타날 것으로 보인다. 하지만 이 중에서 배터리의 전해액을 모델링하는데 있어 가장 적합한 모사연료 조성은 Surrogate 3과 같이 수소의 비율이 높은 연료라고 판단된다. 이 연구에서는 SOC의 효과를 배터리 화재 중 내부에서 생성되는 산소의 양에 기초하였는데, 실험적 연구에 의하면 자발적 생성된 산소의 몰분율은 그리 크지 않고 대부분 탄화수소 물질로 알려져 있다(29). 따라서 가능한 한 작은 양의 산소에 점화가 발생하는 연료조성이 보다 현실적이기 때문이다. 물론 이 연구결과에 의하면 C2H6 또한 반응 중에 H2를 생성하고 있지만, 점화를 위해서는 여전히 높은 산소 농도가 필요하기 때문이다.
4. 결 론
배터리 화재를 모사하기 위해 모사 연료를 설정하고 충전율의 효과를 위해 산소를 첨가하여 수치해석을 수행하였다. 사용한 지배방정식은 가스에너지방정식, 화학종 방정식을 이용하였다. 기존연구를 통해 배터리의 소재에서 발생하는 가연물과 가스포집 실험의 결과를 기초로 조성을 달리한 모사연료 3가지를 설정하여, 배터리 화재에서 나타낼 수 있는 효과를 비교하였다. 산소농도 증가를 통해 열폭주를 모사하는 방식은 모든 열폭주의 요인을 나타낼 수는 없지만, 산소 방출량 증가는 폭발한계의 변화와 함께 산화로 인한 발열량으로 나타나 배터리 화재의 열폭주로 인한 온도상승에 가장 큰 요인으로 보고 이러한 모사를 수행하였다. Surrogate 1은 C2H6, C2H4의 비율을 1:1로 하였으며 Surrogate 2는 CH4와 H2를 추가하여 1:1:1:1로 균등하게 혼합하였으며, Surrogate 3은 1:1:1:7로 설정하여 수소 배출이 매우 높은 배터리 전해질액을 모사하였다.
Surrogate 1과 Surrogate 2의 C2H6 농도를 비교하여 C2H6가 모사연료의 특성을 결정하는 큰 요인임을 알 수 있었다. Surrogate 1과 Surrogate 2는 점화 후 온도감소가 발생하였는데 최고온도가 높을수록 온도감소 또한 크게 나타났다. C2H6의 농도가 높을수록 온도감소 폭이 커지는 이유는 C2H6의 열분해로 인해 H2와 CH4가 생성되는 과정에서 열에너지를 사용하는 것으로 나타났다.
Surrogate 3의 수치해석을 통해 H2의 농도가 모사연료의 연소특성에 미치는 영향을 확인할 수 있었다. 고농도의 H2는 점화가 발생하는 최소산소농도를 낮아지게 하여 연소범위를 넓게 하고 점화지연시간을 증가시켰으며 화염온도를 증가시켰다.
C2H6는 열분해로 인해 기체 몰수의 증가로 압력증가의 주요한 원인으로 나타나 물리적 폭발을 야기하는 주요한 원인으로 나타났으며, H2는 화염온도를 상승시키고 연소범위를 넓게 하여 화학적 폭발의 주요한 원인으로 나타났다. 이러한 특징은 배터리의 폭발을 방지하기 위한 안전설계에 있어서 주요한 인자로 사용될 수 있을 것으로 보인다.
이 연구에서 사용한 3가지 모사연료는 반응 후 온도나 압력에 대한 차이는 존재하지만 SOC에 따른 화재 및 폭발 특성을 잘 나타낸다고 할 수 있다. 하지만 이 중에서 배터리의 전해액을 모델링하는데 있어 가장 적합한 모사연료 조성은 Surrogate 3과 같이 수소의 비율이 큰 연료라고 판단되는데, 가능한 한 작은 양의 산소에 점화가 발생하는 연료조성이 보다 현실적이기 때문이다.